|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
p/kPa |
400 |
370 |
346 |
330 |
320 |
320 |
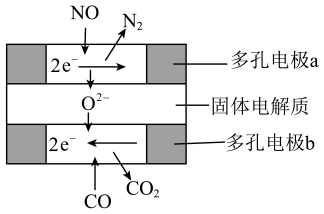
①反应的平衡常数Kp=(Kp为用分压代替浓度计算的平衡常数,分压=总压 ×物质的量分数)。
②实验测得该反应的速率v正=k正·p2( CO )·p2( NO),v逆=k逆·p(N2)·p2(CO2),k正与k逆仅与温度有关。则平衡时k正k逆 (填“>” “<”或“=”,下同)。达到平衡后,仅升高温度,k正增大的倍数k逆增大的倍数。
③未达平衡前,单位时间内要提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是(填标号)。
A.降低温度 B.增大压强
C.使用合适的催化剂 D.降低氮气浓度

②在催化剂甲作用下,反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。

该化学反应的速率主要由反应决定(填“I”“Ⅱ”或“Ⅲ”,下同)。提高反应温度,逆反应速率增加最大的是反应。