








 C . 充电时,
C . 充电时, 在阴极被还原
在阴极被还原




①电池负极电极反应式为;放电过程中需补充的物质A为(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为。

①HCOOD催化释氢反应除生成CO2外,还生成(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是。
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
p/kPa |
400 |
370 |
346 |
330 |
320 |
320 |
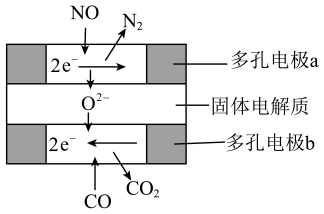
①反应的平衡常数Kp=(Kp为用分压代替浓度计算的平衡常数,分压=总压 ×物质的量分数)。
②实验测得该反应的速率v正=k正·p2( CO )·p2( NO),v逆=k逆·p(N2)·p2(CO2),k正与k逆仅与温度有关。则平衡时k正k逆 (填“>” “<”或“=”,下同)。达到平衡后,仅升高温度,k正增大的倍数k逆增大的倍数。
③未达平衡前,单位时间内要提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是(填标号)。
A.降低温度 B.增大压强
C.使用合适的催化剂 D.降低氮气浓度

②在催化剂甲作用下,反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。

该化学反应的速率主要由反应决定(填“I”“Ⅱ”或“Ⅲ”,下同)。提高反应温度,逆反应速率增加最大的是反应。
上述反应体系中属于非极性分子的化合物是。
恒温恒容时,该反应一定处于平衡状态的标志是。
a.υ正(H2S)=2υ逆(H2) b.CH4的体积分数不再变化
c.不再变化 d.混合气体的密度不再改变
a.一定改变 b.可能增大 c.可能减小 d.可能不变
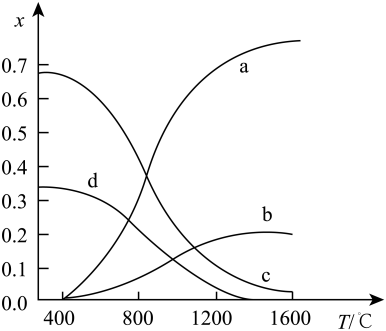
图中表示H2物质的量分数变化的曲线是(选填字母),该反应的正反应为反应(选填“放热”或“吸热”)。保持其他条件不变,升高温度测得CH4的平衡转化率先增大后下降,其原因可能是。
反应Ⅰ 2CH4(g)+O2(g) 2CH3OH(g) △H1= -251.0kJ·mol-1;
反应Ⅱ 2CH4(g)+2O2(g) CH3COOH(g)+2H2O(g) △H2 = -812.4kJ· mol-1。
请回答下列问题:
化学键 | O=O | C-H | O-H |
键能E/kJ·mol-1 | 498 | 414 | 390.8 |
则C-O的键能为kJ·mol-1。

该反应进程中,O2的解离是(填“吸热”或“放热”)的反应,该过程的反应速率(填“大于”或“小于”)CH4的活化反应的反应速率。

通入CH4的电极反应式为该装置工作时发生的能量转化形式为 (不考虑热能的转化)。
|
时间/min |
0 |
10 |
20 |
30 |
40 |
|
总压强/100kPa |
1.0 |
1.2 |
1.3 |
1.4 |
1.4 |
①平衡时,容器中气体总物质的量为mol,H2O的转化率为。
②该温度下反应的平衡分压常数Kp=kPa(结果保留2位有效数字)。

①40min时,再充入的H2的物质的量为mol。
②40~50 min内H2的平均反应速率为mol·L-1·min-1。

①放电时,电极A为极,S发生反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源极相连,阳极的电极反应式为。

工作一段时间后溶液中H2SO4的浓度 (填“变大”、“变小”或“不变”)

过程I的反应为:2HCl(g)+CuO(s) CuCl2(s)+H2O(g) ∆H1
过程II反应的热化学方程式(∆H2用含有∆H和∆H1的代数式表示)。

①反应到6s时,NO2的转化率是。
②根据图示,以下各点表示反应达到平衡状态的是。
a.X b.Y c.Z d.W
③0~3s内容器中NO2的反应速率增大,而3s后容器中NO2的反应速率减小了,原因是。
④此容器中反应达平衡时,温度若为T1℃,此温度下的平衡常数K═。
a.增大CO2的浓度 b.取走一半C6H12O6
c.加入催化剂 d.适当升高温度
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5) /(mol•L﹣1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2) =mol•L-1•min-1。


①b点时,平衡体系中C、N原子个数之比接近;
②a、b、c三点CO的转化率从大到小的顺序为;a、c、d三点的平衡常数从大到小的顺序为。
③若 =0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为。
①2H2(g)+CO(g) CH3OH(g) △H=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.3 kJ/mol
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) 的△H =;二甲醚(CH3OCH3)直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为。
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:。


①溶液中H+的移动方向由极到极;(用 A、B 表示)
②B电极的电极反应式为。

已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
| 化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:

已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(g) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式。
2CH3OH(g)+CO2(g) CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是(填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
③一定条件下分别向甲,乙、丙三个恒容密闭容器中加入一定量的初始物质发生该反应,各容器中温度、反应物的起始量如下表,反应过程中DMC的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T3 |
起始量 | 1molCO2(g) 2molCH3OH(g) | 1molDMC(g) 1molH2O(g) | 2molCO2(g) 2molCH3OH(g) |

甲容器中,在5-15min时的平均反应速率v(CO2)=.乙容器中,若平衡时n(CO2)=0.2mol.则T1T2 (填“>”“<”或“=”)。两容器的反应达平衡时CO2的转化率: 甲丙(填“>”“<."或”=”)。

温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是.
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:.
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用:.
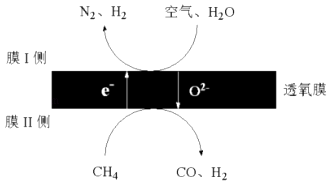
①起还原作用的物质是.
②膜Ⅰ侧发生的电极反应式是.
③膜Ⅰ侧所得气体 =3,CH4、H2O、O2反应的化学方程式是.