 C . CH4的球棍模型:
C . CH4的球棍模型: 

选项 | 实验 | 现象 | 结论 |
A | 将打磨后的镁条放盛入有稀盐酸的试管中 | 用手触摸试管外壁感觉变热 | 镁条与稀盐酸反应是放热反应 |
B | 向某溶液中加铜和稀H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
D | 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[ Cu(OH)2] |



已知:①辉铜矿主要含有Cu2S及少量SiO2、 Fe2O3等杂质,软锰矿主要含有MnO2及少量SiO2、Fe2O3等杂质。
②S在CS2中的溶解度随温度升高而增大;CS2的沸点为46.2 ℃。
③[ Cu(NH3)4]2+(aq)Cu2+ (aq) + 4NH3(aq)
请回答下列问题:
②研究表明矿物中溶解生成的Fe3+可作催化剂,促进Cu2S与MnO2的溶解,其过程有三个反应,反应方程式分别为:(i) Fe2O3+ 3H2SO4=Fe2(SO4)3+3H2O;(ii) Cu2S+ 2Fe2(SO4)3=2CuSO4+4FeSO4+S;写出(iii)的化学反应方程式。


A.第1次读数时,仰视
B.停止加热后,体系未恢复到室温即读数
C.第2次读数时,E管液面高于D管,未调液面即读数

已知:①粗锌中含有少量Cu和FeS。
②Li2S易潮解,在加热条件下易被空气中的O2氧化。
请回答下列问题:

下列有关说法正确的是 (填标号)。
A.采用如图装置过滤的优点是避免析出ZnSO4·7H2O
B.采用如图装置过滤主要是分离FeSO4·7H2O和ZnSO4溶液
C.粗皓矾晶体中可能含少量CuSO4·5H2O杂质
D.洗涤时采用乙醇的原因是减小ZnSO4·7H2O溶解损失
|
t/min |
0 |
1 |
2 |
3 |
4 |
5 |
|
p/kPa |
400 |
370 |
346 |
330 |
320 |
320 |
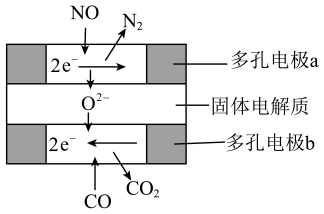
①反应的平衡常数Kp=(Kp为用分压代替浓度计算的平衡常数,分压=总压 ×物质的量分数)。
②实验测得该反应的速率v正=k正·p2( CO )·p2( NO),v逆=k逆·p(N2)·p2(CO2),k正与k逆仅与温度有关。则平衡时k正k逆 (填“>” “<”或“=”,下同)。达到平衡后,仅升高温度,k正增大的倍数k逆增大的倍数。
③未达平衡前,单位时间内要提高汽车尾气中CO、NO的转化率和化学反应速率,应选择的最佳措施是(填标号)。
A.降低温度 B.增大压强
C.使用合适的催化剂 D.降低氮气浓度

②在催化剂甲作用下,反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。

该化学反应的速率主要由反应决定(填“I”“Ⅱ”或“Ⅲ”,下同)。提高反应温度,逆反应速率增加最大的是反应。
①基态氮原子的电子排布图为。
②上述涉及的元素H、B 、C、N、O中电负性最大的是(填元素符号)。

①上述三种物质中,沸点最高的是(填化学名称)。
②吡啶中氮原子的杂化轨道的空间构型为。
③已知咪唑中存在类似苯的大π键,则在咪唑分子的两个氮原子中,更容易与Cu2+形成配位键的是(填“①”或“②” )号氮原子。


①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②若晶胞中距离最近的两个铁原子距离为apm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。

已知: 。
。
回答下列问题:
A的化学名称为。
有机物F是布洛芬的同系物,F的同分异构体同时满足下列条件的总数为种。

a.相对分子质量比布洛芬小28;
b.苯环上仅有两个取代基,且羧基与苯环直接相连。
其中分子中核磁共振氢谱有4组吸收峰,峰值比为9:2:2:1,布洛芬的结构简式为。