①上述滴定操作用到的仪器有。
A. B.
B. C.
C. D.
D.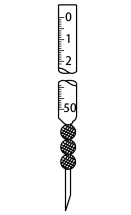
②该盐酸浓度为。
序号 | 反应试剂 | 体系温度/ | ||
反应前 | 反应后 | |||
i | | | a | b |
ii | | a | c | |
①温度:bc(填“>”“<”或“=”)。
②(选择表中一组数据计算)。结果表明,该方法可行。
查阅资料:配制溶液时需加入酸。加酸的目的是。
提出猜想:粉与
溶液混合,在反应A进行的过程中,可能存在
粉和酸的反应。
验证猜想:用试纸测得
溶液的
不大于1;向少量
溶液中加入
粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和(用离子方程式表示)。
实验小结:猜想成立,不能直接测反应A的焓变。
教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。
优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为。

查阅资料:SO2在酸性条件下还原性较差,碱性条件下较强。
实验步骤:i.配制Cu(OH)2悬浊液:往NaOH溶液中加入CuSO4溶液可得到Cu(OH)2悬浊液。
ⅱ.将SO2通入Cu(OH)2悬浊液中(实验装置如图F)。
实验现象:F中出现少量红色固体,稍后,溶液呈绿色,与CuSO4溶液、CuCl2溶液的
颜色有明显不同。

配制Cu(OH)2悬浊液时,要保证溶液过量。(填“NaOH”或“CuSO4”)

①根据上述实验可得结论:该红色固体为。
②产生红色固体的原因是(用离子方程式表示)。
ⅱ.取少量F中滤液,加入少量稀盐酸,产生无色刺激性气味的气体,得到澄清的蓝
色溶液。再加入BaCl2溶液,出现白色沉淀。
①实验i的目的是。
②溶液显绿色的原因可能是溶液中含有较多Cu (HSO3)2。小组同学通过进一步实验确认了这种可能性,在少量1mol·L-1的CuSO4溶液中加入(填化学式),得到绿色溶液。
Ⅰ.实验准备:饱和氯水的制备
①取溶液于试管中,滴加3滴
溶液,溶液变红色;
②取溶液于试管中,先滴加3滴
溶液,振荡,溶液无现象,再滴加3滴饱和氯水,溶液变黄色。
【发现问题】小组成员针对实验②中溶液未变红色,而呈现黄色的现象展开了探究。
【查阅文献】
i.能将
氧化成
, 硫氰
常温下为黄色液体,易挥发,可与水发生反应:
;
ii. ,
为无色配合物。
【提出猜想】猜想一 被氯水氧化成
, 使溶液呈黄色;
猜想二 加入氯水后部分被氧化为
,
(红色),但由于存在反应:
, 实验②生成的
浓度比实验①的小,
溶液在浓度较低时呈黄色。
【验证猜想】为验证猜想,小组成员设计了以下实验,请补充表格中的操作及现象
实验序号 | 实验操作 | 现象 | 实验结论 |
③ | 取少量实验①的溶液于试管中, | 猜想二正确 | |
④ | 取少量实验②的溶液于试管中,滴加3滴饱和 | 溶液变浑浊 | 猜想一也正确 |
| 实验序号 | 实验操作 | 现象 |
⑤ | 滴加3滴蒸馏水 | 无明显现象 | |
⑥ | 滴加3滴饱和氯水 | 无明显现象 | |
⑦ | 溶液变橙红色 | ||
⑧ | 滴加3滴 | ||
得出结论 | i.由实验⑥的现象可以判断:猜想一不正确, ii.结合实验⑤⑦⑧的现象可以判断:猜想二正确。 | ||

84消毒液和医用酒精均为重要的消毒剂且二者不能混用,某小组对84消毒液与医用酒精的反应产物进行了探究.
【提出假设】医用酒精中的被氧化为
【实验方案】实验方案及现象如下:
实验操作 | 取样检测时间点 | 实验现象 |
常温下将 | ① | |
橙黄色沉淀 | ||
黑色沉淀 |
【实验结论1】产物中有乙醛,且乙醛会被转化为其它物质.补充①的实验现象:.
【查阅资料】混合体系中可能发生以下反应:
(卤化反应)
【实验设计】取2份84消毒液,缓慢滴加医用酒精或蒸馏水各
, 通过测定过程中
变化判断是否发生卤化反应(忽略过程中的热效应对
的影响).实验结果如图.

【实验结论2】数据表明,反应过程中增大,说明乙醛发生了卤化反应.
【查阅资料】某同学查阅资料后认为结论2不严谨,原因是工业上为了稳定 , 在84消毒液中添加了少量
, 且由于乙醇的“锁水”效应也会使
增大(提示:乙醇与
不反应).
【数据分析】②已知上述实验:84消毒液中 .
通过计算证明84消毒液中添加了少量 , 写出计算过程.
【实验总结】医用酒精中的乙醇能被84消毒液氧化为乙醛,乙醛能进一步发生卤化反应.
实验装置图 | 实验序号 | 实验试剂a | 实验现象 |
| ① |
| 产生白色沉淀 |
② | 2mL“生菠菜”榨出的汁 | 产生白色沉淀 | |
③ | 2mL“熟菠菜”榨出的汁 |
①称取650g菠菜样品研磨成汁,用稀硫酸浸泡后取澄清溶液(假设草酸和草酸盐全部浸出);②将步骤①中的澄清溶液定容,得到250mL待测液;③移取25.00mL待测液,用的酸性
溶液滴定。
上述操作中,不需要的仪器有。(填序号)
①达到滴定终点的现象依据是。
②滴定时:+
滴定次数 | 草酸溶液体积/mL | 标准液体积/mL | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.00 | 25.99 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.23 |
计算:菠菜样品中草酸和草酸盐的总含量为%(均以草酸计)。
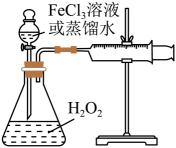
②设计实验方案:在不同条件下,测定。(要求所测得的数据能直接体现反应速率大小)
实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
I | 10 | a | 0 | 无明显变化 |
II | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
III | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
①表格中a=,b=。
②通过实验和(填写序号)探究浓度对反应速率影响。
①反应i离子方程式为。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
原理预测:
请写出与Cu的反应的离子方程式:.
某实验小组在进行与Cu的反应时观察到了异常现象,决定对其进行进一步的探究.
实验Ⅰ:

提出问题:
实验前,小组同学预测步骤2后溶液不会变为红色,原因是.
查阅文献:i.CuSCN为难溶于水的白色固体;
ii.被称为拟卤素离子,性质与卤素离子相似.
提出猜想:经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能.
猜测1:与KSCN发生了氧化还原反应.
猜测2:亚铁离子将其还原 ,
.
设计实验:
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
II | A试管 | 加入 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
B试管 | 加入 | 溶液变成绿色 | |
II | C试管 | 加入 | 溶液变为淡蓝色 |
再加 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
得出结论: