反应1:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ·mol-1(a<0)
反应2:4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=bkJ·mol-1(b>0)
反应3:4S2(g)=S8(s) ΔH3=ckJ·mol-1(c<0)
如果上述反应均能完全进行,为提高硫黄的产率,该工艺中需要控制反应1和反应2烟气的体积比为。
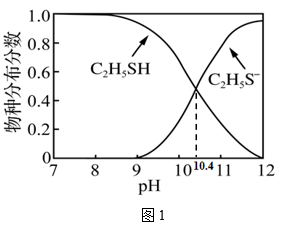
已知:Ka1(H2S)=9×10-8 , 分别从电离常数和共价键极性的角度比较H2S和C2H5SH酸性强弱:
①(电离常数);
②(共价键极性)。
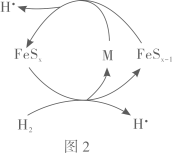

①图3中所示的转化过程可描述为。
②图2中FeSx和H2反应生成M、FeSx-1和H•的化学方程式为。
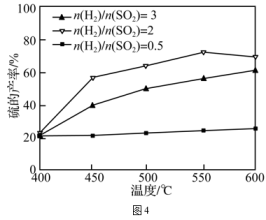
③其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率与温度和n(H2)/n(SO2)比值的关系如图4所示。500℃时,n(H2)/n(SO2)比值为3时硫的产率小于比值为2时的原因是。