|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
NO2 |
石灰水 |
|
② |
HCl |
CO2 |
石灰水 |
|
③ |
CO2 |
SO2 |
BaCl2 |
|
④ |
Cl2 |
SO2 |
BaCl2 |
|
⑤ |
CO2 |
NH3 |
CaCl2 |
|
温度/℃ |
20 |
40 |
60 |
80 |
|
pH |
11.80 |
11.68 |
11.54 |
11.42 |
下列说法正确的是( )
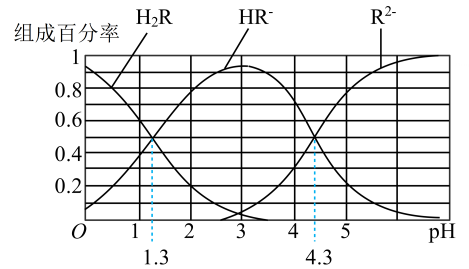
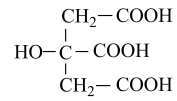 分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )
分子式为C6H8O7)属于三元弱酸,25℃其电离平衡常数的pKa=-1gKa , pKa1=3.14,pKa2=4.77,pKa3=6.39。下列说法错误的是( )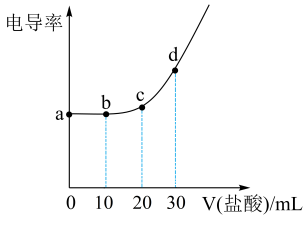
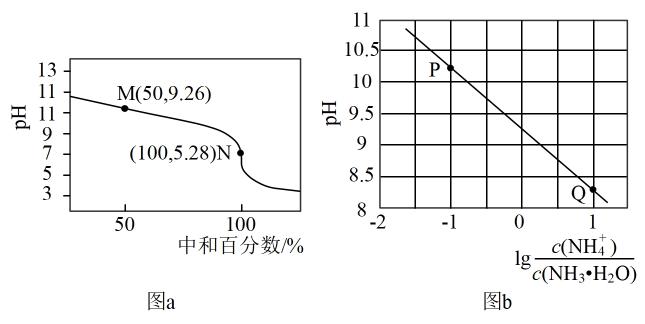
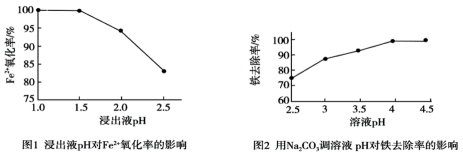
已知:i.pH越大,c(H+)越小;ii.酸性条件下MnO2被还原为Mn2+
下列说法不合理的是( )
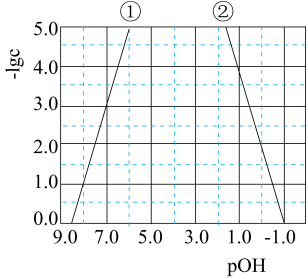

已知NaHS溶液显碱性,则:
①某电解水实验开始时,向纯水中溶解了
。此时溶液中
和水分子的个数比是。
②当实验进行到一段时间,两个石墨电极共收集到的气体质量为。计算此时被电解的水的物质的量是。
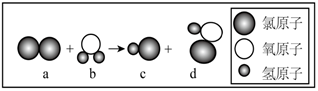
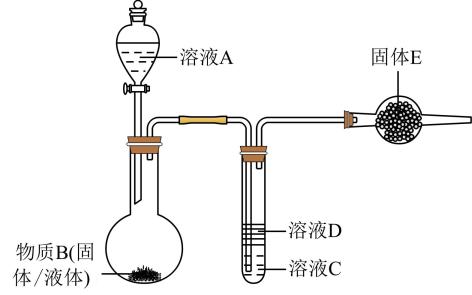
A | B | C | D | E | |
实验1 | 70%的 | | | | 碱石灰 |
实验2 | 浓盐酸 | 浓 | | 淀粉—KI溶液 | 碱石灰 |
实验3 | ? | ? | | | 碱石灰 |
实验4 | 浓氨水 | | | 水 | —— |
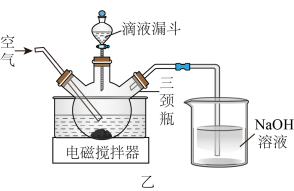
Ⅰ.某同学利用图1装置研究盐酸与氢氧化钠溶液反应的过程,并用和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
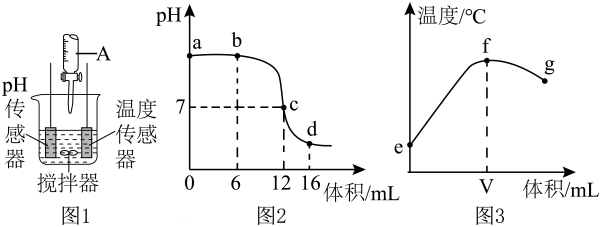
A.图2中点所示溶液中的溶质是
和
B.取图2中点所示溶液加热蒸干所得固体为纯净物
C.图2中所示溶液中
的质量不断增加
D.图3中变化趋势可说明该反应是放热反应
反应1:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ·mol-1(a<0)
反应2:4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=bkJ·mol-1(b>0)
反应3:4S2(g)=S8(s) ΔH3=ckJ·mol-1(c<0)
如果上述反应均能完全进行,为提高硫黄的产率,该工艺中需要控制反应1和反应2烟气的体积比为。
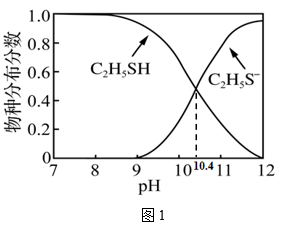
已知:Ka1(H2S)=9×10-8 , 分别从电离常数和共价键极性的角度比较H2S和C2H5SH酸性强弱:
①(电离常数);
②(共价键极性)。
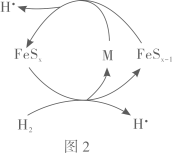

①图3中所示的转化过程可描述为。
②图2中FeSx和H2反应生成M、FeSx-1和H•的化学方程式为。
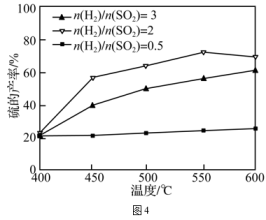
③其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率与温度和n(H2)/n(SO2)比值的关系如图4所示。500℃时,n(H2)/n(SO2)比值为3时硫的产率小于比值为2时的原因是。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入气体的速率
D.通过多孔球泡向氧化镁浆料中通