 制SO2
B .
制SO2
B . 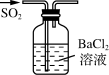 制BaSO3沉淀
C .
制BaSO3沉淀
C .  验证SO2的还原性
D .
验证SO2的还原性
D . 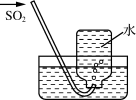 收集SO2
收集SO2
选项 | 实验操作和实验现象 | 结论 |
A | 在一块除去铁锈的铁片上滴1滴含有酚酞的食盐水静置2~3min,溶液边缘出现红色 | 铁片上发生了吸氧腐蚀 |
B | 将足量H2O2溶液滴入少量的酸性高锰酸钾溶液溶液紫色褪去 | H2O2具有漂白性 |
C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口,试纸颜色无明显变化 | 原溶液中无 |
D | 向Na2CO3、Na2S的混合溶液中滴入少量AgNO3溶液,有黑色沉淀生成 | Ksp(Ag2S)<Ksp(Ag2CO3) |
实验 | 实验操作和现象 |
1 | 用pH试纸测得0.1mol·L-1NaHCO3溶液的pH约为8 |
2 | 向0.1mol·L-1NaHCO3溶液中加入过量0.1mol·L-1Ba(OH)2溶液,产生白色沉淀 |
3 | 向0.1mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液 |
4 | 向浓NaHCO3溶液中加入浓Al2(SO4)3溶液,有气体和沉淀生成 |
下列说法不正确的是( )
反应II:CO2(g)+H2(g) CO(g)+H2O(g)ΔH2=+42.5kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)ΔH3=—90.7kJ·mol-1
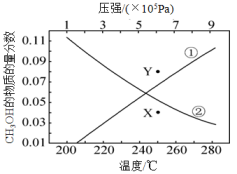
下列说法正确的是( )

[已知:+
→CO2↑+Mn2+(未配平)]

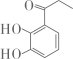 , 写出同时满足下列条件的该有机物的一种同分异构的结构简式:
, 写出同时满足下列条件的该有机物的一种同分异构的结构简式:①分子中有四种不同化学环境的氢;②与FeCl3溶液能发生显色反应,且1mol该物质最多能与3molNaOH反应。

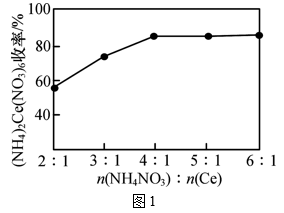
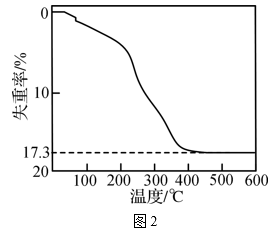
反应1:2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ΔH1=akJ·mol-1(a<0)
反应2:4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ΔH2=bkJ·mol-1(b>0)
反应3:4S2(g)=S8(s) ΔH3=ckJ·mol-1(c<0)
如果上述反应均能完全进行,为提高硫黄的产率,该工艺中需要控制反应1和反应2烟气的体积比为。
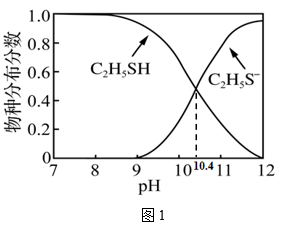
已知:Ka1(H2S)=9×10-8 , 分别从电离常数和共价键极性的角度比较H2S和C2H5SH酸性强弱:
①(电离常数);
②(共价键极性)。
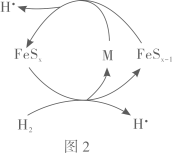

①图3中所示的转化过程可描述为。
②图2中FeSx和H2反应生成M、FeSx-1和H•的化学方程式为。
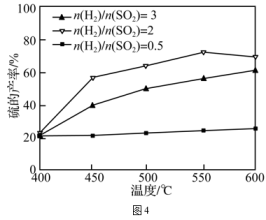
③其他条件一定,改变起始时H2与SO2的比例,反应相同时间,测得S的产率与温度和n(H2)/n(SO2)比值的关系如图4所示。500℃时,n(H2)/n(SO2)比值为3时硫的产率小于比值为2时的原因是。