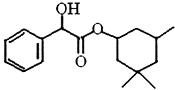
I.制备碳酸亚铁:装置如图所示。
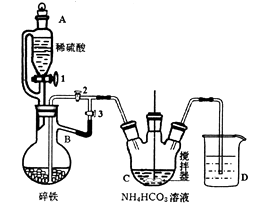
向纯净的FeCO3固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。
该反应方程式为。为防止乳酸亚铁变质,在上述体系中还应加入。反应结束后,将所得溶液隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥得乳酸亚铁晶体。该晶体存放时应注意。
两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是。
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00g样品配制成250.00mL溶液,取25.00mL用0.10mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为(以质量分数表示)。
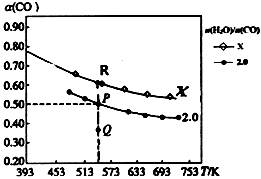
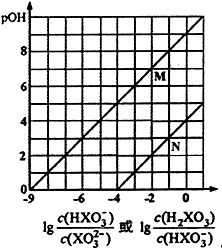
①R点平衡常数K=。
②氢碳比X2.0(填“>”或“<”或“=”),判断的理由是。
③下列能提高CO平衡转化率的措施有。
A.使用高效催化剂
B.通入He气体使体系的压强增大
C.降低反应温度
D.投料比不变,增加反应物的浓度
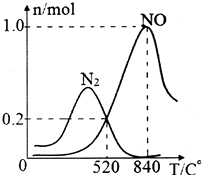
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H<0
氨催化氧化时会发生上述两个竞争反应I和Ⅱ。为分析该催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2 , 反应关系如图,该催化剂在高温时选择反应(填“I”或“II”)。520℃时,4NH3(g)+3O2(g) 2N2(g)+6H2O(g)的平衡常数K=(只需列出数字计算式)。
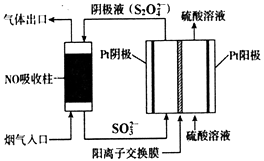
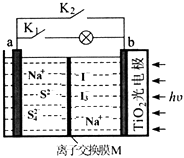
①阴极区的电极反应式为。
②NO吸收转化后的主要产物为NH4+ , 若通电时电路中转移了0.3mol e- , 则此通电过程中理论上吸收的NO在标准状况下的体积为mL。
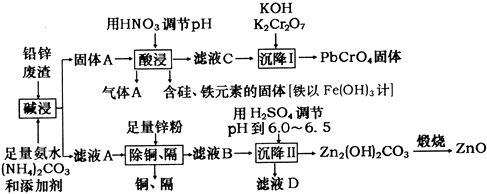
已知常温下Ksp(PbSO4)=1.6×10-5 , Ksp(PbCO3)=7.4×10-14 , Ksp[Fe(OH)3]=1.0×10-38。

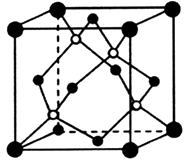
①与Au距离最近的Cu个数为。
②该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为,则晶胞中Cu原子与Au原子中心的最短距离d=cm。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为( )。