
 用图所示装置除去乙烯中少量SO2气体
B .
用图所示装置除去乙烯中少量SO2气体
B .  用图装置量取20.00 mL 0.10 mol•L﹣1硫酸
C .
用图装置量取20.00 mL 0.10 mol•L﹣1硫酸
C .  用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D .
用图所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D .  用图装置制备Fe(OH)2并能较长时间观察其颜色
用图装置制备Fe(OH)2并能较长时间观察其颜色





①属于芳香族化合物 ②苯环上只有1个取代基 ③属于酯类物质
① ![]()
![]()
② 
 R、R′表示烃基
R、R′表示烃基
合成F的一种改良法是以 ![]() 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br CH3CHOH
CH3COOCH2CH3 .
①SO2还原法:向1000L含0.002mol•L﹣1 Cr2O72﹣的酸性废水中通入SO2使Cr2O72﹣全部转化为Cr3+ , 至少需要通入 L SO2(标准状况)
②铁屑还原法:向含Cr2O72﹣的酸性废水中加入废铁屑,加热充分反应后,加入熟石灰调节溶液的pH,使Cr3+完全沉淀.
已知25℃时,Ksp[Cr(OH)3]=6.3×10﹣31 . 欲使溶液中残余Cr3+的物质的量浓度为6.3×10﹣7 mol•L﹣1 , 应调节溶液的pH=.
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会.
②计算废水中铬元素总浓度(单位:mg•L﹣1 , 写出计算过程)
已知测定过程中发生的反应如下:
①2Cr3++3S2O82﹣+7H2O=Cr2O72﹣+6SO42﹣+14H+
②Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O
③I2+2S2O32﹣=2I﹣+S4O62﹣ .

实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(I)过氧化氢比理论用量稍多,其目的是.
(II)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是.
(III)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是.
(IV)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是.最后经结晶分离、干燥得产品.
金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
实验步骤
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:.
步骤3:.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、、洗涤、60℃时干燥得甲酸钙晶体.
Ⅰ.SO2+2H2O+I2=H2SO4+2HIⅡ.2H2SO4=2SO2+O2+2H2OⅢ.2HI=H2+I2
在反应器中加入SO2、I2、H2O的物质的量分别为1mol、9mol、16mol,充分反应静置后得到混合物分成两层﹣﹣上层是含低浓度I2的H2SO4层和下层是高浓度的I2的HI层.
①根据上述事实,下列说法正确的是(选填序号).
a.H2SO4溶液和HI溶液不互溶
b.HI溶液的密度大于H2SO4溶液的密度
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是.
③HI层中存在I﹣+I2⇌I3﹣ , c(H+) c(I﹣)+c(I3﹣)(填大于、小于或等于)
2SO3(g)=2SO2(g)+O2(g)△H=+196kJ/mol
则2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)的△H=kJ/mol
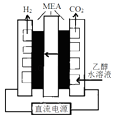
①通电电解前需要向阴极区通入氩气,其目的是
②写出阳极电极反应式.

a.常温下,N2很稳定,是因为N的电离能大
b.钠晶胞结构见图2,每个晶胞含有5个钠原子
c.第一电离能(I1):N>O>P>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有.