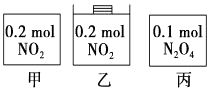
①已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式。
②已知①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=,联氨和N2O4可作为火箭推进剂的主要原因为。
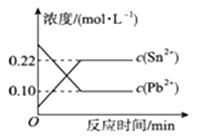
①该反应的逆反应为热反应,且m+np(填“>”“=”“<”)。
②若加入B(体积不变),则A的转化率,B的转化率(填“增大”“减小”或“不变”)。
③若升高温度,则平衡时B、C的浓度之比 将。
④若加入催化剂,平衡时气体混合物的总物质的量。
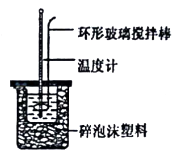
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
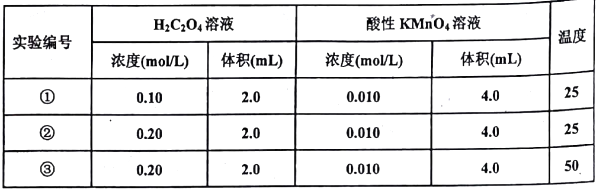
已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4 , 为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥。
a.高温高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3
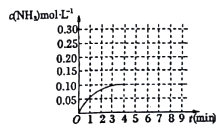
N2(g)+3H2(g) 2NH3(g) △H<0反应中NH3的物质的量浓度的变化情况如图所示: