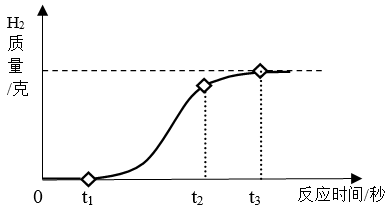
 B . 闻药品气味
B . 闻药品气味  C . 滴加液体
C . 滴加液体  D . 稀释浓硫酸
D . 稀释浓硫酸 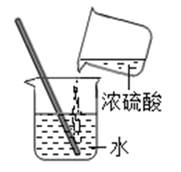
| 序号 | 物质 | 杂质 | 所用试剂 |
| A | 氢气 | 氯化氢 | 氢氧化钠溶液 |
| B | 二氧化硫 | 水 | 碱石灰 |
| C | 氧化钙 | 碳酸钙 | 适量的稀盐酸 |
| D | 氢氧化钠 | 碳酸钠 | 适量的氯化钡溶液 |
 B .
B .  C .
C .  D .
D . 

| 甲 | 乙 | |
| A | 稀硫酸 | 氢氧化钠溶液 |
| B | 稀盐酸 | 碳酸钙粉末 |
| C | 稀盐酸 | 锌粒 |
| D | 硝酸银溶液 | 铜粉 |
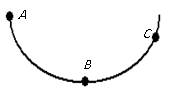
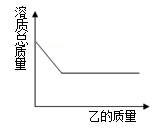
①保持不变; ②一直减小; ③先增大后减小
④一直增大; ⑤先减小后增大

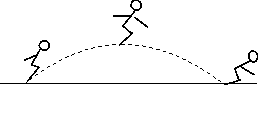
Ⅰ.将铁片浸入稀硫酸 Ⅱ.将铜片浸入称硫酸 Ⅲ.将铁片浸入硝酸银溶液

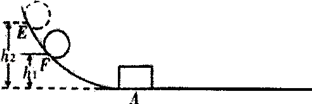
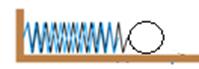
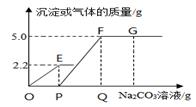
步骤一:让铁球甲从斜面E点静止滚下,打到A处木块,推动木块;
步骤二:让铁球甲从斜面F点滚下,打到A处相同的木块,推动木块;
步骤三:换一铁球乙(m乙>m甲)从斜面上F点静止滚下,打到A处相同的木块,推动木块。
猜想一:只有NaCl; 猜想二:有NaCl和HCl; 猜想三:有NaCl和NaOH
为探究溶质的成分,他们进行以下实验:
|
实验方案 |
测溶液pH |
滴加Na2CO3溶液 |
滴加AgNO3溶液 |
|
实验操作 |
| | |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
根据上述实验结果,同学们得出猜想是正确。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na +2H2O====2NaOH +H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
|
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
|
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
|
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
|
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
|
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如下表所示。
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
⑵实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水旒酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。.
①下列化肥中,属于氮肥的是。(填字母)
A.碳酸氢铵[NH4HCO3] B.草木灰(主要成分[K2CO3] C.磷矿粉[Ca3(P04)2]
②草木灰呈碱性,你认为它(“能”或“不能”)与所选的氮肥混合施用,理由是。
①目的是促进绿色植物的光合作用。
②若提供的气体肥料CO2中混有少量的SO2 , 为了除去SO2 , 现设计以下两种方法。
甲方法:将气体通过足量的碳酸氢钠溶液。乙方法:将气体通过足量的氢氧化钠溶液。
【提供资料】 :
I.CO2与NaHCO3不会发生反应。 Ⅱ.SO2+2NaHCO3==Na2SO3+H2O+2CO2
Ⅲ.SO2+2Na0H==Na2SO3+H2O
请你利用提供的资料和所学的知识分析:上述方法(填“甲”或“乙”)可行,理由是.
|
装置 |
反应前 |
反应后 |
|
A |
试管的质量36.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量54.8 克 |
|
B |
反应后瓶内液体比反应前增重1.1 克 |
|
分析数据发现,反应中消耗碳和氧元素的质量(填“大于”或“小于”或“等于”)生成二氧化碳的质量. 下列4项中跟这一结果有关的有哪几项? .(填编号)
A.装置中还有一部分CO2未被NaOH溶液吸收 B.氧化铜和炭粉反应产生的气体除CO2外还有CO
C.氧化铜和炭粉没有完全反应 D.该反应不符合质量守恒定律