时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
| 选项 | 溶液中的离子 | 通入(或加入)过量的某种物质 |
| A | H+、Ba2+、Fe3+、NO3- | 通入SO2气体 |
| B | AlO2-、Na+、Br-、SO42- | 通入CO2气体 |
| C | HCO3-、Na+、I-、HS- | 加入AlCl3溶液 |
| D | Ca2+、Cl-、K+、H+ | 通入CO2气体 |
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣



写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式。
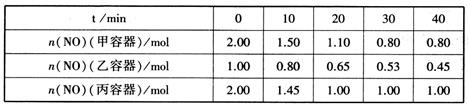
①该反应为(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=。
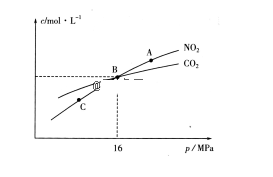
①A、C两点的浓度平衡常数关系:Kc(A)Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是(填“A”或“B”或“C”)点。
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)=CO2(g) ΔH2
③H2(g)+1/2O2(g)=H2O(l) ΔH3
则反应④2C(s)+H2(g)=C2H2(g)的ΔH=。(用含ΔH1、ΔH2、ΔH3的关系式表示)
| 时间/min 浓度/(mol·L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①1~10 min内,NO的平均反应速率v(NO)=,T1℃时,该反应的平衡常数K1=。T2温度下的平衡常数为K2 , 若T1>T2 , 则K1K2
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.通入一定量的NO
b.加入一定量的C
c.适当升高反应体系的温度
d.加入合适的催化剂
e.适当缩小容器的体积
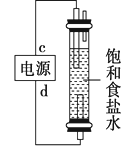
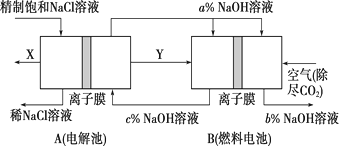
①燃料电池B中的电极反应式分别为
负极:,
正极:。
②分析图3可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为。