
 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B .  正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH−
C .
正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH−
C .  锌筒作负极,发生氧化反应,锌筒会变薄
D .
锌筒作负极,发生氧化反应,锌筒会变薄
D .  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A,C,D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
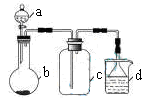
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸(70%) | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |





| n/mol t/min | | | |
| 0 | 2.0 | 2.4 | 0 |
| 5 | 0.9 | ||
| 10 | 1.6 | ||
| 15 | 1.6 |
下列说法正确的是( )

①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是( )
|
气体(杂质) |
方法 |
|
|
A |
SO2(H2S) |
通过酸性高锰酸钾溶液 |
|
B |
Cl2(HCl) |
通过饱和的食盐水 |
|
C |
N2(O2) |
通过灼热的铜丝网 |
|
D |
NO(NO2) |
通过氢氧化钠溶液 |
|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |
化学性质 | 实际应用 | |
A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
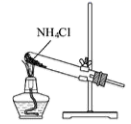 制取氨气
B .
制取氨气
B . 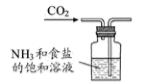 制取碳酸氢钠
C .
制取碳酸氢钠
C . 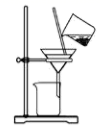 分离碳酸氢钠
D .
分离碳酸氢钠
D . 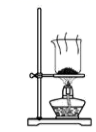 干燥碳酸氢钠
干燥碳酸氢钠
 B . 中子数为45的硒原子:
B . 中子数为45的硒原子:  D . 基态氯原子的电子排布式:1s22s22p63s23p5
D . 基态氯原子的电子排布式:1s22s22p63s23p5
 B . CO2的电子式:
B . CO2的电子式:|
① |
② |
③ |
|||||||||||||||
|
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||||||
|
⑨ |
⑩ |
SiO2 +______C
+_____N2 ______Si3N4 + ________CO
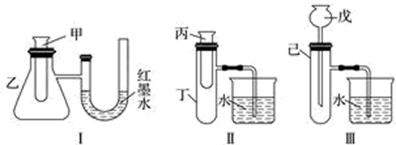
①若M为钠,则实验过程中烧杯中可观察到的现象是。
②若观察到烧杯中产生气泡,则说明M溶于水(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是。
方法①:选择装置(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是(填“吸热”或“放热”)反应。

|
实验编号 |
初始pH |
废水样品体积mL |
草酸溶液体积mL |
蒸馏水体积mL |
|
① |
4 |
60 |
10 |
30 |
|
② |
5 |
60 |
10 |
30 |
|
③ |
5 |
60 |
|
|
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(用代数式表示)。
假设一:Fe2+起催化作用;
假设二:;
假设三:;
……
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O72-的浓度可用仪器测定。)
|
实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
|
|
|