 D . 中子数为146、质子数为92的铀(U)原子:
D . 中子数为146、质子数为92的铀(U)原子: 
 B . 中和滴定
B . 中和滴定  C . 制MgCl2
C . 制MgCl2  D . 制乙酸乙酯
D . 制乙酸乙酯 

反应I:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ·mol-1
反应II:CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
 B .
B . 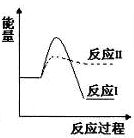 C .
C .  D .
D . 




操作Y用到的玻璃仪器有烧杯、,操作Z的名称为。


|
热化学方程式 |
平衡常数 |
|
|
主反应 |
Si(s)+3HCl(g) | K1 |
| 副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则;若温度太高,SiHCl3则会转化生成SiCl4 , 该转化的热化学方程式为。
②平衡时, 的值a随着
的值b的变化而变化,则
=(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
的值,请用平衡移动原理加以解释。



①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3 , 要使反应釜中的H3PO4几乎全部转化成LiH2PO4 , 反应釜中需要控制溶液的pH=。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是。
②铁的百分含量Fe(%)=。