
B、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是( )
| 选项 | a | b | c | 气体 | 装置 |
| A | 浓氨水 | 生石灰 | 浓硫酸 | NH3 | |
| B | 浓H2SO4 | 铜屑 | NaOH溶液 | SO2 | |
| C | 稀HNO3 | 铜屑 | H2O | NO | |
| D | 稀盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | CO2 |

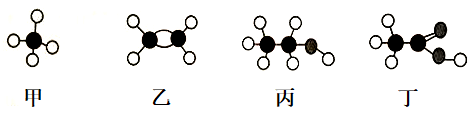
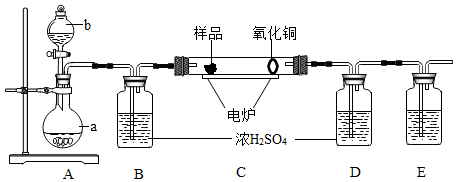
下图是用燃烧法来确定有机物组成的常用装置。其方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量来确定有机物的组成。
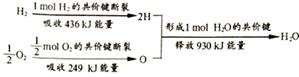
已知:装置C中的氧化铜是确保有机物中的碳元素完全转化为二氧化碳,A中的反应为2H2O2 2H2O+O2↑。
|
实验编号 |
盐酸浓度/(mol/L) |
铁的形态 |
温度/K |
|
① |
4.00 |
块状 |
293 |
|
② |
4.00 |
粉末 |
293 |
|
③ |
2.00 |
块状 |
293 |
|
④ |
2.00 |
粉末 |
313 |
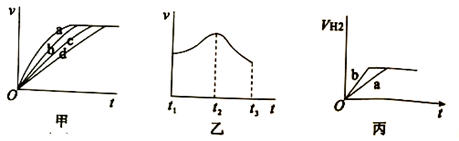
①其中t1~t2速率变化的主要原因是。
②t2~t3速率变化的主要原因是 。
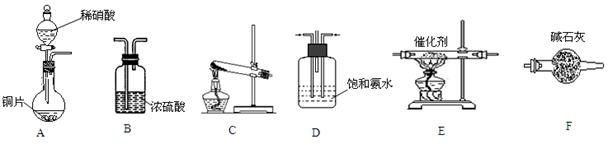
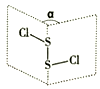
资料信息:无水AlCl3在178℃升华,极易潮解,遇到潮湿空气会产生白色烟雾。
利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。
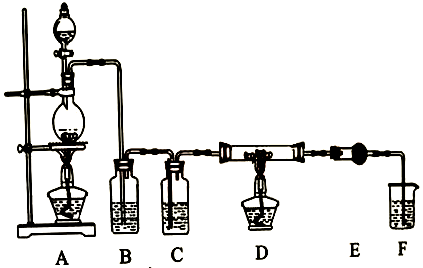
写出装置A发生的反应方程式。
探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.。
|
步骤 |
实验操作 |
预测现象和结论 |
|
① |
往不再产生氯气的装置中,加入继续加热 |
若有黄绿色气体生成,则假设1成立 |
|
② |
|
若有黄绿色气体生成,则假设2成立 |
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
|
第一次实验 |
第二次实验 |
第三次实验 |
|
|
D中固体用量 |
2.0g |
2.0g |
2.0g |
|
氢气的体积 |
334.5mL |
336.0mL |
337.5mL |
根据表中数据,计算所得固体中无水AlCl3的质量分数。