|
温度/℃ |
10 |
20 |
30 |
40 |
|
|
溶解度/g |
Na2CO3 |
12.2 |
21.8 |
39.7 |
48.8 |
|
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
|
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
|
①生成NaHCO3的化学方程式为。
②结合上表分析,析出NaHCO3晶体的原因可能有(填序号)。
A. 溶剂质量减少
B. 同温下NaHCO3溶解度小于NaCl
C. 生成的NaHCO3质量大于消耗的NaCl质量

①冷却到室温 ②弹簧夹夹紧橡皮管 ③点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧
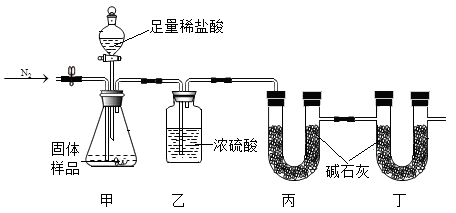
①另一个物理量为(填序号)。
A 滴下的稀盐酸质量 B 反应前后乙装置增加的质量
C 反应前后丙装置增加的质量 D 反应前后丁装置增加的质量
②若去掉丁装置,测得CaCO3含量(填“偏高”、“偏低”或“不变")。
③甲装置中反应结束后打开止水夹再通入一会儿N2的目的是。