 混合
B .
混合
B .  成型
C .
成型
C .  干燥
D .
干燥
D .  烧结
烧结
| 问题 | 答案 | |
| A | 厨房里常用的一种物质,可以用它来发馒头,也可以做洗涤剂 | 他是烧碱 |
| B | 医疗上用来配制生理盐水,日常生活中可用来调味 | 它是葡萄糖 |
| C | 由碳和氢两种元素组成的气态化合物,也是农村沼气池中有植物残体分解产生的可燃性气体,容易充分燃烧,是清洁能源 | 它是甲烷 |
| D | 一种氧化物,它既能与酸性氧化物反应,又能与碱性氧化物反应,但都不生成盐 | 无这样的氧化物 |
 B . 称固体
B . 称固体  C . 量取水
C . 量取水 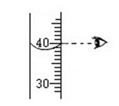 D . 写标签
D . 写标签 
 B .
B .  C .
C .  D .
D . 


| 选项 | 实验目的 | 所用试剂或方法 |
| A | 鉴别氢氧化钠溶液和饱和石灰水 | 升高温度 |
| B | 检验一瓶气体是否为CO2 | 燃着的木条 |
| C | 分离铁粉和铜粉混合物 | 稀硫酸 |
| D | 除去NaOH溶液中的Na2CO3 | 适量氢氧化钙溶液 |



长岭中心中学九(1)班化学兴趣小组对上述报道产生浓厚兴趣,为此进行探究,请你一起参入。
(查阅资料)电石[CaC2]是一种重要的化工原料,遇水即发生剧烈反应并放出大量的热,生成一种可燃气体[C2H2]和一种白色固体。
(提出问题)白色固体是什么物质?
(进行猜想)小明猜想白色固体可能是CaO、Ca(OH)2、Ca(HCO3)2或CaCO3中的一种。
(实验探究)小浩对白色固体讲行探究,请你帮忙完成。
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
小浩的方案 |
取少量白色固体于试管中,向其中加入稀盐酸 |
固体溶解,无气泡冒出 |
|
|
我的方案 |
|
|
白色固体是Ca(OH)2 |
(综合应用)结合上述事例,请你就易燃易爆物在贮存和运输时应注意的事项,提出一条合理建议: 。
(拓展创新)氢氧化钙在空气中易变质,若变质后的固体中只含有碳酸钙和氢氧化钙,取变质后的固体17.4g加入到150g稀盐酸中恰好完全反应,生成二氧化碳的质量为4.4g。则变质后的固体中碳酸钙的质量分数为,反应后所得溶液中溶质的质量分数为(只写计算式)
(探究一)硫酸的性质
①用小木棍蘸取少量浓硫酸,放置一会后,可观察到。
②浓硫酸的稀释:浓硫酸稀释过程如图1所示,b中盛放的物质是,a的作用是。
③兴趣小组把98%的浓硫酸10mL和63.3%的硫酸溶液约20mL分别放入两个相同的小烧杯中,称量、观察、记录、分析,根据室温环境下实验的数据绘成的曲线如图2,由图2曲线你能得到的实验结论:,(写两点)。
图1 
图2 
如图3将适量的稀硫酸分别加入A~E的五只烧杯中。
图3 
①有产生气泡的是(填序号,下同);有白色沉淀生成的是。
②能证明C中发生化学反应的现象是。
工业上以黄铁矿为原料生产硫酸的工艺流程如图4所示
。 
①接触室中发生的化学方程式为。
②依据生产硫酸的工艺流程图,下列说法正确的是(填字母序号)。
A、为使黄铁矿充分燃烧,需将其粉碎
B、催化剂能够提高SO2的反应速率和产量
C、吸收塔中得到的产品为混合物
D、沸腾炉排出的矿渣可供炼铁
③接触室中的SO2平衡转化率与温度及压强的关系如图5所示。催化剂活性与温度的关系见图6.在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是;。
图5SO2平均转化率与温度压强的关系 
图6催化剂活性与温度的关系 
同学们进行了如下实验探究。
(查阅资料)①4FeS2+11O2 2Fe2O3+8SO2
②Na2SO3+H2O2=Na2SO4+H2O
(实验探究)
Ⅰ称取1.60g黄铁矿样品放入如图7所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应。
图7 
Ⅱ反应结束后,将乙瓶中的溶液进行如图8处理
图8 
(问题讨论)
①I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是;II中滤液所含的溶质一定有。
②(含量测定)
II中最终得到的4.66g固体是(填化学式)。
③计算该黄铁矿中FeS2的质量分数为。(写出计算过程)
①如果缺少甲装置,则最终测得FeS2的质量分数将会(填“偏大”“偏小”“不变”)
②如何证明II中所加BaCl2溶液已过量(请简要写出操作方法及现象)。


图3 
①仪器A的名称为。B装置中发生的主要反应的化学方程式为。
②为了成功制得碳酸亚铁,实验开始时打开(填K1、K2、K3 , 下同)关闭。待B中反应即将结束时再打开K2关闭K3 , 目的是。C中反应方程式是。