 B . 建筑材料
B . 建筑材料  C . 制肥皂
C . 制肥皂  D . 人工降雨
D . 人工降雨 


| 实验方案 | 使用的试剂 | 判断的方法 |
| A. | 铁粉 | 如果有气泡产生,表明盐酸已经过量 |
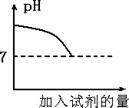
| B. | pH 试纸 | 如果 pH<7,表明盐酸已经过量 |
| C. | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| D. | 紫色石蕊试剂 | 如果溶液变成红色,表明盐酸已经过量 |
 B .
B .  C .
C .  D .
D . 

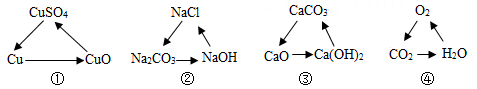
①木炭 ②白酒 ③头发 ④醋酸 ⑤小苏打 ⑥蛋清 ⑦生石灰


第一步:通过观察发现E 溶液呈蓝色,其它溶液均为无色;
第二步:取少量 A、B、C、D 溶液,分别滴加 E 溶液,现象为:A 溶液中出现白色沉淀,B 溶液中出现蓝色沉淀,C 和D 溶液均无明显现象;
第三步:取第二步中产生的蓝色沉淀,滴加C 溶液后沉淀消失。则:


【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3 为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设 a:该灰黑色沉淀可能含有; 假设 b:该灰黑色沉淀可能含有 AlCl3;
假设 c:该灰黑色沉淀可能含有难溶于酸的物质。
|
实验编号 |
实验操作 |
实验现象 |
|
① |
加入适量稀盐酸 |
有微量气泡,固体全部溶解,得到澄清溶液 |
|
② |
加入适量蒸馏水 |
固体部分溶解 |
|
③ |
加入适量无水乙醇 |
固体部分溶解 |
【得出结论】该灰黑色沉淀的成分是。
猜想一:生成物中除铜离子外可能还有亚铁离子猜想二:可能与铜离子浓度偏大有关
猜想三:可能是由于温度不同所造成的
|
盐酸溶质质量分数(%) |
0 |
0.18 |
0.36 |
1.8 |
3.6 |
5.5 |
11 |
22 |
|
反应时间(s) |
20 |
18 |
13 |
11 |
21 |
37 |
65 |
114 |
|
温度(℃) |
30 |
40 |
50 |
|
NaOH溶解度(克) |
119 |
129 |
145 |
|
NaCl溶解度(克) |
36.3 |
36.6 |
37 |
【发现问题】 氯水中的哪些成分能使品红褪色呢?
【查阅资料】 氯气溶于水,部分与水反应,方程式为 Cl2 + H2O = HCl + HClO。其中,
HClO 的名称叫次氯酸,是一种弱酸,具有强氧化性。
【猜想】猜想 1:是氯水中的水使品红褪色的;
猜想 2:是氯水中的(填化学式)使品红褪色的; 猜想 3:是氯水中的盐酸使品红褪色的;
猜想 4:是氯水中的次氯酸使品红褪色的。
【实验探究】
|
实验操作 |
实验现象 |
过程分析 |
|
①把品红试纸伸入水中 |
没有褪色 |
猜想 1 不成立 |
|
②把品红试纸伸入干燥的氯气中 |
没有褪色 |
猜想 2 不成立 |
|
③ |
没有褪色 |
猜想 3 不成立 |
【结论】综合分析:氯水中的(填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
小明:可能是个偶然现象。
小东:可能是浑浊液体中的固体氢氧化镁使酚酞试液变红,氢氧化镁沉降后溶液就变无色了。
小花:可能是酚酞试液与空气中的氧气反应,使红色消失;也可能是氢氧化镁溶液与空气中的二氧化碳反应的缘故。
小红:可能是在热水中氢氧化镁的溶解度大,溶液中 OH- 离子较多,使酚酞试液变红;过一会儿温度降低,氢氧化镁的溶解度减小,溶液中 OH-离子变少,酚酞试液又变无色。
实验步骤 | 设计目的 |
将氢氧化镁加入到热水中搅拌,滴入酚酞试液,并在上方滴一些植物油。 |
实验方法 | 可能观察到的现象 | 相应结果或结论 |
取两支试管,分别加入相同质量的氢氧化镁和相同质量的热水振荡,各滴加数滴酚酞试液。一支保持温度不 变,另一支自然冷却。 | 保持温度不变的红色不消失,自然冷却的红色消失。 |

请计算:

请分析数据,回答下列问题:



【研究方案】先称取 13.3g 的 NaOH 样品(杂质为 Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为 14.6% 的稀盐酸, 根据生成 CO2 的质量测定
Na2CO3 的质量。从而进一步确定样品中NaOH 的变质程度。
|
Na2CO3 的质量/g |
|
|
变质NaOH 的质量/g |
|
|
NaOH 的变质程度(用质量分数表示) |
|
