 B . 从 a 处通气收集 O2
B . 从 a 处通气收集 O2  C . 测定溶液的 pH
C . 测定溶液的 pH D . 加热液体
D . 加热液体 
 B .
B .  C .
C .  D .
D . 


①镁和铝与稀盐酸反应的剧烈程度不同;
②不能用铜与稀硫酸反应制取氢气;
③用硫酸铜、石灰乳配置农药波尔多液时,不能用铁制容器;
④ 铜能和浓硫酸反应。


①木炭 ②白酒 ③头发 ④醋酸 ⑤小苏打 ⑥蛋清 ⑦生石灰






①沉淀 B 的化学式为。
②他的同桌认为该同学的结论不正确,请你帮他说出理由。
查阅资料:①相互接触的两种活动性不同的金属,同时放入酸中,活动性较强的金属与酸反应产生氢气的速度会大大加快。②硫酸铜对锌和稀硫酸反应没有催化作用。
小柯根据下表进行实验,观察并记录现象。
|
组别 |
第一组 |
第二组 |
||
|
A |
B |
C |
D |
|
|
金属 |
锌片 |
绑有铜片的锌片 |
铁片 |
绑有铜片的铁片 |
|
30%硫酸溶液(mL) |
20 |
? |
20 |
20 |
|
产生气泡快慢 |
快 |
明显加快 |
慢 |
明显加快 |
【猜想】①是氧气;②是氯化氢;③是氨气(NH3);④是氢气。他们马上否定了猜想
③,否定的依据是;
【实验探究】他们开始着手收集所产生的气体。
实验一:他们用带火星的木条检验该气体,木条不复燃。说明生成的气体不是氧气; 实验二:为继续探究反应后生成的气体是否是氯化氢,他们用检验该气体, 试纸不变红,说明生成的气体不是氯化氢;
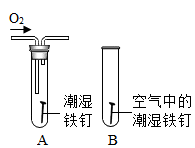
实验三:为确定气体是否是氢气,他们设计了如图所示的实验(每个装置的反应均完全)。

为确定该气体产生的本质原因,他们用精密pH试纸测试实验所用的CuCl2溶液,pH约为5.5。查阅资料发现:CuCl2为强酸弱碱盐,其水溶液呈酸性,与实验结果相符。
他提出了如下猜想,并进行了实验探究:
①Cl-能促进铝片和稀酸反应,SO42-对反应无影响。
②Cl-对反应无影响,SO42-能抑制铝片和稀酸反应。
|
组别 |
1 |
2 |
|
相同的铝片 |
1 克铝片 |
1 克铝片 |
|
H+浓度相同的酸 |
5 毫升盐酸 |
5 毫升硫酸 |
|
反应片刻后添加少量某试剂 |
Na2SO4 |
NaCl |
|
添加试剂后的反应现象 |
无明显变化 |
明显加快 |
|
结论 |
和对反应无影响 |
对反应有促进作用 |
根据上述探究过程,请回答下列问题:
请你将表格中的空白处补充完整。
资料:部分物质的溶解性

物质 | MgCl2 | CaCl2 | Mg(OH)2 | Ca(OH)2 |
溶解性 | 溶 | 溶 | 难溶 | 微溶 |
根据以上信息回答:

①计算:m(KOH)=g,V(H2O)=mL(水的密度近似为 1.0g·mL-1)
②称取氢氧化钾:调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后(按操作先后顺序,填字母),直至天平平衡。
③量取水;
④溶解;
⑤转移。
A.向烧杯中加氢氧化钾固体 B.按需要添加砝码、移动游码
取酸性废水样品 100g,逐滴加入 5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)。
①P 点对应溶液中一定存在的阳离子有(填离子符号)。
②废水中硫酸的质量分数为。
(已知:氢氧化钡溶液和稀硫酸的密度均大于水的密度;不考虑产生的沉淀对溶液密度的影响)


请计算:
|
次 数 |
第 1 次 |
第 2 次 |
第 3 次 |
第 4 次 |
|
加入稀盐酸质量 /g |
25 |
25 |
25 |
25 |
|
反应后烧杯中物质的总质量 /g |
m |
58.4 |
82.6 |
107.6 |
求:
①图Ⅱ装置中油层的作用是;
②甲组的实验步骤是:取 20 克样品,逐渐滴加稀盐酸溶液,最终测得 CO2 的体积为 440毫升(二氧化碳的密度取 2 克/升),请计算样品中 NaCl 的质量分数。
①乙组完成实验需要多次使用玻璃棒,该实验中玻璃棒的作用有(写出一种即可)。
②样品中的碳酸钠全部反应时,参加反应的稀盐酸的溶质质量是。