
| 选项 | 酸 | 碱 | 盐 | 氧化物 |
| A | HNO3 | Na2CO3 | Cu(NO3)2 | Fe3O4 |
| B | HCl | NaOH | NaCl | C2H6O |
| C | H2SO4 | KOH | NH4NO3 | H2O |
| D | H2O2 | Ca(OH)2 | ZnSO4 | O2 |
 B .
B .  C .
C .  D .
D . 

①S+O2 SO2 ②CaCO3
CaO+CO2 ③SO2+2NaOH=Na2SO3+H2O ④CaCO3+2NaOH=Na2CO3+Ca(OH)2 ⑤SO2+CaO
CaSO3
下列说法不正确的是( )
 B .
B .  C .
C .  D .
D . 
①潮湿的衣服经太阳晒后,变干了;②铜在潮湿的空气中生成铜绿;③纸张燃烧;④瓷碗破碎;⑤铁生锈;⑥石蜡熔化。
A.BaCl2 B.CuSO4 C.AgNO3 D.KNO3
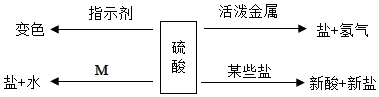


①取少量废液,向废液中滴加NaOH溶液,有白色沉淀生成;
②另取少量废液,向其中滴加 BaCl2 溶液,无明显现象;
③再取少量废液,滴加AgNO3溶液,产生白色沉淀,加稀硝酸后沉淀不溶解。
请分析实验后回答:
废液中一定含有的离子是,可能含有的离子是;
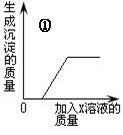


现进行下列实验操作:
⑴将白色粉末放入足量水中,得无色澄清溶液。
⑵向无色澄清溶液中加入氯化钡溶液,有白色沉淀生成。
⑶向白色沉淀中加入足量的稀硝酸,有部分沉淀溶解,并生成能使澄清石灰水变浑浊的气体。
根据以上实验事实推断,该白色粉末中一定有,一定没有

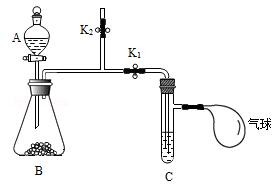
【实验 1】打开 K1 , 关闭 K2 , 将 A 中溶液滴入 B 中,气球明显鼓起,打开 K2 , 关闭 K1 , 一段时间后,气球没有明显变瘪。
实验1没出现预期的实验现象,改进后重新加入药品进行实验2。
【实验 2】打开 K2 , 关闭 K1 , 将 A 中液体滴入 B 中,用燃着的木条放在 K2上方的导管口处,木条熄灭。上述实验操作的目的是。然后进行后续实验, 证明二氧化碳与氢氧化钠发生了反应,后续实验的操作及现象是。写出二氧化碳和氢氧化钠反应的反应的化学方程式。
药品:稀硫酸、稀盐酸、氢氧化钠溶液、碳酸钠溶液、硝酸钡溶液、氯化钠溶液、酚酞溶液
【查阅资料】硝酸钡溶液显中性,且 Ba2+有毒.
【实验探究】小江做了下列几组实验.
|
组合序号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
组合物质 |
H2SO4、NaOH |
H2SO4、 NaCl |
H2SO4、Na2CO3 |
H2SO4、 Ba(NO3)2 |
NaOH、 Ba(NO3)2 |
Na2CO3、 Ba(NO3)2 |
实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液.为 了确定清液的成分,继续展开探究.
①取少量清液于试管中,向其中滴加几滴硝酸钡溶液,无明显现象.
②另取少量清液于另一只试管中,滴加几滴_,有白色沉淀产生.
【解释与结论】探究活动结束后,小组内成员通过讨论分析,一致认为清液中含有的离子除Na+、Cl﹣外,还有_(指示剂除外).
【处理废液】为了防止污染环境,小江向废液缸中加入适量的,对废液进行处理后,将 固体回收进一步处理,溶液排放.

测量次数 | 第1次 | 第6次 | 第16次 | 第21次 | 第26次 |
滴加的盐酸总质量/g | 0 | 5 | 15 | 20 | 25 |
溶液总质量/g | 50 | 55 | m | 69.78 | 74.78 |
溶液 pH | 12.4 | 12.1 | 7.0 | 2.2 | 2.1 |
请分析计算:
①取10克样品于烧杯中,加入蒸馏水充分溶解,配制成60克溶液。
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应。
③将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为14.35克。
A.晶体没有干燥 B.蒸发时液体飞溅 C.硝酸钾残留在玻璃棒上
