
 B .
B . 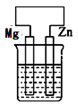 C .
C . 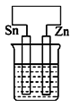 D .
D . 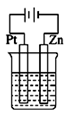
| 实验目的 | 实验操作 | |
| A | 验证Cu(OH)2的溶度积比Mg(OH)2的小 | 将0.1 mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶于适量蒸馏水 |
| C | 证明NH3·H2O是 弱电解质 | 室温下,用蒸馏水润湿的pH试纸测定0.1mol·L-1氨水溶液pH |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |




①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=。有利于提高CH4平衡转化率的条件是(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为mol2·L-2。






方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
则A的分子式为,写出符合条件的A的一种结构简式

溶浸液中金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
A.NaOH B.ZnO C.ZnCl2 D.ZnCO3