


处理 | 外植体数/个 | 分化苗数/苗 | 脱毒苗数/苗 |
小于0.3mm | 20 | 1 | 1 |
0.3﹣0.5mm | 20 | 10 | 7 |
大于0.6mm | 20 | 13 | 4 |

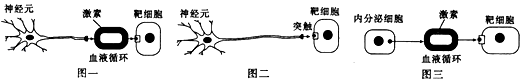
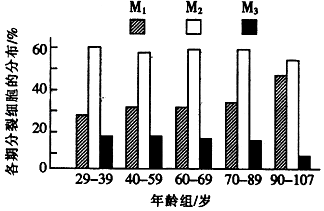
①样本来源:采集某地区20﹣107岁健康成年人的外周血淋巴细胞,分成5个年龄组.
②细胞培养:将血细胞接种到含有20%小牛血清培养基中,在37℃下培养20﹣24h后,加入少量 5﹣溴脱氧尿嘧啶核苷(BrdU,可代替胸腺嘧啶整合到复制形成的子代DNA中,并通过特异性染色显示含BrdU的染色体,依据染色深浅判断增殖速度),继续培养至72h,在收获前6h加入适宜浓度的秋水仙素.
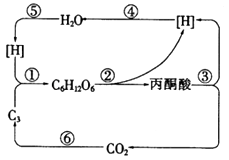
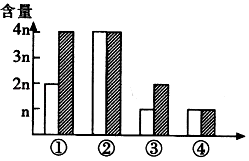
③判断与比较细胞周期:取经染色的细胞制成临时装片,每组观察100个中期细胞,根据细胞染色体上姐妹染色单体的染色深浅,分别记录为M1、M2、M3期的细胞数,求出各期细胞的百分比.结果统计如下图.其中细胞染色体的两条姐妹染色单体均被深染;M2期细胞中两条姐妹染色单体一条被深染,一条被浅染;M3期细胞中姐妹染色单体均被浅染的细胞数占 或更多.
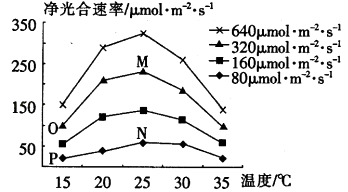
光照强度 分蘖率/% 温度 | 15℃ | 20℃ | 25℃ | 30℃ | 35℃ |
80μmol•m﹣2•s﹣1 | 50 | 74.2 | 62.2 | 58.7 | 0.0 |
160μmol•m﹣2•s﹣1 | 68.9 | 80.2 | 80.8 | 68.3 | 21.7 |
320μmol•m﹣2•s﹣1 | 60.9 | 78.7 | 76.2 | 57.9 | 42.5 |
640μmol•m﹣2•s﹣1 | 64.5 | 75.6 | 72.2 | 52.2 | 50.0 |
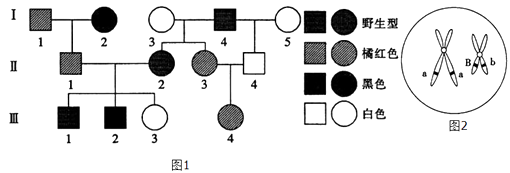
①若该细胞是由于基因重组引起的:;
②若该细胞是由于基因突变引起的:.
①卵母细胞的收集和体外培养:从屠宰场水牛的卵巢中收集并处理卵母细胞,随机分成5组,分别置于不同浓度亚麻酸的培养液中,在的培养箱中培养22﹣24h.
②卵母细胞成熟判断:在显微镜下观察卵母细胞,判断其是否成熟,统计结果如表1.
③体外受精:在受精溶液中进行体外受精后,用显微镜观察判断是否完成受精.
④早期胚胎培养:将受精卵移入胚胎培养液中培养44﹣48h后检查分裂情况,每隔48h更换一次培养液,第5﹣9天观察囊胚发育情况,统计结果如表2.
表1亚麻酸对水牛卵母细胞体外成熟的影响
ALA浓度/μmol•L﹣1 | 卵母细胞数 | 核成熟卵子数 |
0 | 229 | 137 |
10 | 201 | 133 |
50 | 227 | 166 |
100 | 215 | 137 |
200 | 215 | 135 |
表2亚麻酸对水牛早期胚胎发育的影响
ALA浓度/μmol•L﹣1 | 培养卵数 | 分裂数 | 囊胚数 |
0 | 309 | 171 | 75 |
10 | 325 | 182 | 82 |
50 | 292 | 185 | 97 |
100 | 310 | 188 | 84 |
200 | 231 | 145 | 68 |
混养方式 | A方式 | B方式 | |
放养密度/尾•ha﹣1 | 草鱼 | 3000 | 9000 |
鲢鱼 | 9000 | 3000 | |
鲤鱼 | 900 | 900 | |
投饲量和追肥量/kg•ha﹣1 | 氮肥、磚肥 | 1.8×103 | 0 |
青草料 | 4.85×104 | 1.17×105 | |
光能量利用率/% | 5.76 | 10.85 | |
青草料利用率/% | 10.13 | 13.89 | |
水体能见度/cm | 20 | 30 | |
鱼产量/kg•ha﹣1 | 7515 | 11490 | |
①将液氮冷冻的组织研磨成粉末
↓
②分别用A、B、C三种不同方法处理
↓
③DNA粗提液在65℃水浴保温60min,搅拌均匀
↓
④加氯仿﹣异戊醇,离心取?,加冷酒精,收集沉淀
↓
⑤加入RNA酶,37℃水浴保温20min,重复步骤④
↓
⑥将沉淀室温干燥后,溶于超纯水中,﹣20℃保存备用
结果检测
组织 | 方法 | 组别 | OD260/OD230 | OD260/OD280 | 得率/μg•mg﹣1 |
嫩叶 | A方法 | A1 | 1.970 | 1.821 | 0.105 |
B方法 | B1 | 1.973 | 1.719 | 0.096 | |
C方法 | Cl | 1.647 | 1.568 | 0.082 | |
块根 | A方法 | A2 | 1.888 | 1.888 | 0.029 |
B方法 | B2 | 1.811 | 1.682 | 0.030 | |
C方法 | C2 | 1.376 | 1.320 | 0.020 |
注:①纯净的DNA样品OD260/OD230值约为2.0,过低表明小分子物质残留较多;②纯净的DNA样品OD260/OD280值约为1.8,若比值大于1.8表示存在RNA残留,若小于1.8表示存在蛋白质残留.③得率是指每毫克组织所提取的DNA量.

①只出现一条带的原因是.
②出现“拖尾”现象的原因是.