实验操作 | 实验现象 |
取该固体于试管中,加水、振荡 | 固体不溶解 |
取该固体于试管中,加盐酸、振荡 | 固体溶解,无气泡产生 |
一氧化碳通过炽热的该固体,称固体质量、检测尾气 | 固体质量减轻,尾气中只检测到CO与CO2 |
实验室用加热无水醋酸钠与碱石灰固体混合物来制取并收集一瓶较为纯净的甲烷气体,则应选用图中的装置(填字母)。
A. 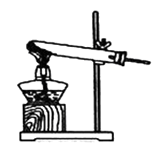 B.
B. 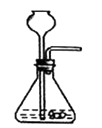 C.
C. 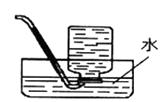 D.
D. 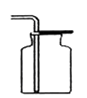 E.
E. 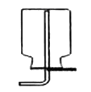
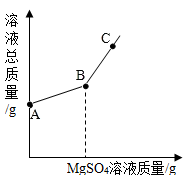
硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服剂,俗称“钡餐”。小柯将硫酸镁溶液滴入硝酸钡[Ba(NO3)2]溶液中得到硫酸钡,如图表示该实验过程中溶液总质量随加入硫酸镁溶液质量的变化情况。图线AB段对应的实验现象是,C点处溶液中的溶质有。
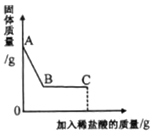
有一包白色固体样品,可能含碳酸钠、硫酸钠、氯化钠、氢氧化钠中的一种或几种。小科同学为探究其成分做了以下实验:
Ⅰ.取少量固体样品于烧杯中,先加足量水溶解,再加入足量的BaCl2溶液,有白色沉淀产生;
Ⅱ.继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图所示。
请回答下列问题:
【建立猜想】①两种酸溶液的pH不同.(注:pH相同,则单位体积溶液中H+数目相同)
②两种酸溶液中的不同.
【实验过程】
|
实验次数 |
试剂 |
实验条件 |
实验现象 |
|
1 |
0.2克CuO粉末+6毫升pH=0的盐酸 |
常温 |
黑色粉末很快溶解,溶液呈蓝绿色 |
|
2 |
0.2克CuO粉末+6毫升pH=0的硫酸 |
常温 |
无明显现象 |
|
3 |
0.2克CuO粉末+6毫升pH=0的硫酸+0.35克NaCl |
常温 |
黑色粉末很快溶解.溶液呈蓝绿色 |
|
4 |
0.2克CuO粉末+6毫升pH=0的硫酸+0.35 |
常温 |
无明显现象 |
【实验结论】常温下,pH相同的盐酸和硫酸溶液于CuO反应现象出现差异的原因是由于促进了反应的进行.
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后的产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl2、MgO、HCl气体、H2O、Cl2。
老师告诉他产物就是上述猜想中的其中几种,并提示Cl2是一种黄绿色有刺激性气味的气体。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有气体,无其他气体。
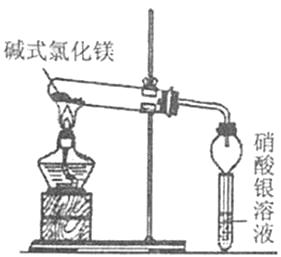
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生。由此推知Mg(OH)Cl分解后产物中没有。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生。由此推知Mg(OH)Cl分解后产物中没有。
【结论】Mg(OH)Cl受热分解的化学反应方程式为。
白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠)。
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
步骤 | 操作 | 现象 |
1 | 将食品干燥剂加入适量清水中,搅拌后静置 | 放出大量的热 |
2 | 取步骤1中的上层清液,先加入牵牛花汁液, | 溶液由无色变为蓝色,再变为紫色,最后变为红色 |
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。
定性分析
【实验目的】确定白色固体的组成
【实验方案】
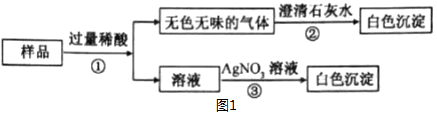
【实验结论】该白色固体由NaHCO3和NaCl两种物质组成
a.基于上述实验结论,则步骤①中加入的过量稀酸应该是。
b.写出步骤②中生成白色沉淀的化学反应方程式。
定量分析
【实验目的】测定该白色固体中NaHCO3的质量分数
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案Ⅰ:利用NaHCO3与稀硫酸反应产生CO2 , 通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
a.小吕用下列装置完成本实验,装置的连接顺序是(填装置的字母编号,装置不重复使用);

b.D装置中的反应完全后,需再次通入空气,其目的是。
小周方案Ⅱ:小周用沉淀法测定样品中NaHCO3的质量分数。操作流程如下:
(已知:NaHCO3+NaOH=Na2CO3+H2O)
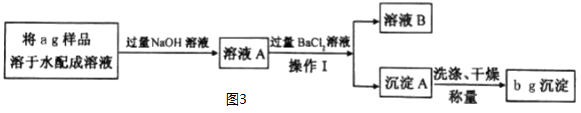
c.为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案:。
每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。

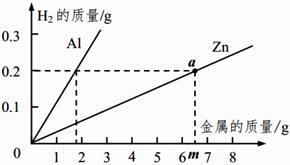
为了进一步确定“银粉”是铝还是锌,学习小 组通过理论计算,获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。
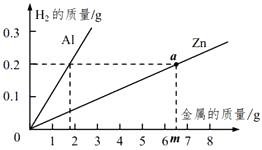
取1.8克“银粉”(杂质忽略不计)加入到50克稀盐酸中,恰好完全反应,生成氢气0.2克。根据上图可知,“银粉”是。计算实验中所用稀盐酸的溶质质量分数。
A组实验有:①过滤含泥沙的食盐水;②蒸发氯化钠溶液获得晶体;③用实验室方法制取一瓶二氧化碳。甲同学抽到的是A组中的一个实验,需要如下器材:
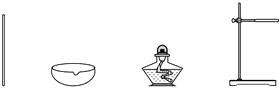
则他抽到的实验是(选填序号)。
他应称取固体氯化钠克。
为了进一步确定“银粉”是铝还是锌,学习小组通过理论计算, 获得两种金属分别与足量盐酸反应产生氢气的质量关系,并绘制成如图所示图像。在绘制锌的图像时,a点所对应的锌的质量m为多少?(通过计算回答)