称取某石灰石样品20g在高温条件下充分煅烧(杂质不反应),称得剩余固体为13.4g,求该石灰石样品中CaCO3的质量分数.(提示:石灰石的主要成分为碳酸钙,碳酸钙高温分解的化学方程式为CaCO3![]() CaO+CO2↑ )
CaO+CO2↑ )
①生成BaSO4的质量.
②BaCl2溶液中溶质的质量分数(写出计算过程)
C3H8O+4O2 4H2O+2CO2+X,
①生成物X的化学式为.
②要使6.0g丙醇燃烧时不生成X,则消耗氧气的质量至少为 g.
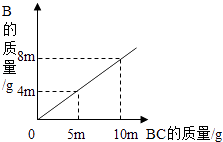
物质 | A | B | C | D |
反应前质量/g | 1.7 | 2.2 | 7.9 | 0.9 |
反应后质量/g | 待测 | 6.6 | 0 | 2.7 |
则反应后A的质量为;
该反应中B和D两种物质变化的质量比为.
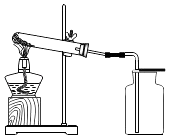
如图所示进行实验,受热分解的化学方程式为,3.16g KMnO4产生O2的质量为g.
【查阅资料】KMnO4溶液呈中性、有腐蚀性
【进行实验】
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如表
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表.
编号 | ① | ② | ③ | ④ | |
实验 |
25mL0.1%KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫酸 | |
铜片 质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
【解释与结论】
实验1的目的是
5Cu+2KMnO4+8H2SO4=5CuSO4+2MnSO4+K2SO4+.
Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1 .
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2 .
Ⅲ.实验数据如下表:
反应前总质量m1 | 反应后总质量m2 |
371.84g | 371.24g |

回答下列问题: