①电子流动方向从Zn﹣灯泡﹣Cu﹣盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.


①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.

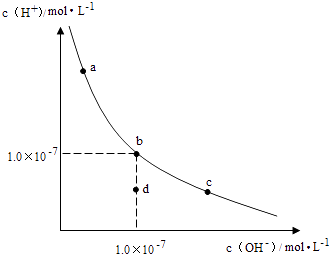


请回答下列问题:
①E的大小对该反应的反应热(填“有”或“无”)影构.
②图中△H=kJ/mol.
①写出该反应的热化学方程式:.
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+ O2(g)=H2O(l)的△H=kJ/mol.
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
①完全沉淀后,溶液中c(Ag+)=.
②完全沉淀后,溶液的pH=.
①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为.
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)=.

(25℃,假设电解前后溶液的体积无变化).
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是.
①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.

①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×10﹣4 mol/L的KMnO4溶液.