① H2SO3+I2+H2O=2HI+H2SO4 ② 2FeCl3+2HI=2FeCl2+2HCl+I2
①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应
①16H++10Z﹣+2XO4﹣=2X2++5Z2+8H2O
②2A2++B2=2A3++2B﹣
③2B﹣+Z2=B2+2Z﹣根据上述反应,下列结论判断不正确的是( )


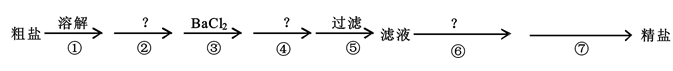
④步所加试剂是。
+→+++H2O
②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目。
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以1计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
KlO3+KI+H2SO4=K2SO4+I2+H2O
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
a.准确称取wg食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
C++ H2SO4——++Cr2(SO4)3+H2O

①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+ , 最终生成胶状沉淀,这种胶状沉淀是(写化学式)。
Fe2++ O2 + H+= Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为L。