
 C . 氯原子的结构示意图是
C . 氯原子的结构示意图是  D . 中子数为7的碳原子是
D . 中子数为7的碳原子是 
| | | | |
| A.配制一定物质的量浓度的NaOH溶液 | B.实验室制取Cl2 | C.验证铁的析氢腐蚀 | D.验证氨气易溶于水 |
| 事 实 | 推 测 | |
| A | ⅣA 族 14Si 和 32Ge 的单质是半导体材料 | 同族 82Pb 的单质是半导体材料 |
| B | HI 在 230℃时分解,HCl 在 1500℃时分解 | HF 分解温度大于 1500℃ |
| C | H3PO4 是中强酸,H2SO4 是强酸 | HClO4 是强酸 |
| D | Na、Al 通常用电解法冶炼 | Mg 可用电解法冶炼 |
① 将 SO2 通入 AgNO3 溶液(pH=5)中,得到无色溶液 A 和白色沉淀 B;
② 取洗涤后的沉淀 B,加入 3 mol/L HNO3 , 产生的无色气体遇空气变成红棕色;
③ 向溶液A中滴入过量盐酸,产生白色沉淀;取上层清液继续滴加 BaCl2 溶液,未出现 白色沉淀。
已知:ⅰ.经分析,沉淀 B 可能为 Ag2SO3、Ag2SO4 或二者混合物
ⅱ.Ag2SO4 微溶于水,Ag2SO3 难溶于水
下列说法不正确的是( )
① 已知上述反应中生成 1 mol NH3 放出 46 kJ 热量,该反应的热化学方程式为。
②该反应放热,但仍选择较高温度。其原因是。
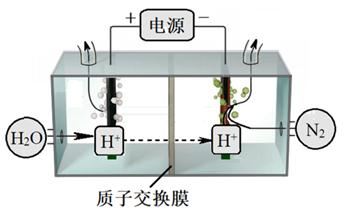
① 阴极生成氨的电极反应式为。
② 阳极氧化产物只有 O2。电解时实际生成的 NH3 的总量远远小于由 O2 理论计算所得 NH3 的量,结合电极反应式解释原因:。
![]()
已知:氮原子利用率是指目标产物中氮的总质量与生成物中氮的总质量之比
上述反应③的氮原子利用率为 66.7%。要使原料 NH3 转化为 NH4NO3 的整个转化过程
中氮原子利用率达到 100%,可采取的措施是
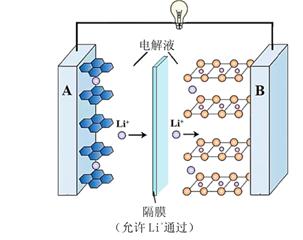
① 该电池放电时,其中一极的电极反应式是 LixC6 – xe- = 6C + xLi+,则该极应为上图中的(填“A”或“B”)
② 碳酸乙烯酯(EC)常用作电解液的溶剂,其结构为 ![]() ,熔点 35℃,可燃,可由二氧化碳和有机物 X 在一定条件下合成。X 与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成 EC 的化学方程式:。
,熔点 35℃,可燃,可由二氧化碳和有机物 X 在一定条件下合成。X 与乙醛互为同分异构体,核磁共振氢谱显示只有一组峰。写出合成 EC 的化学方程式:。
③ 从正极材料中回收钴和锂的流程如下:
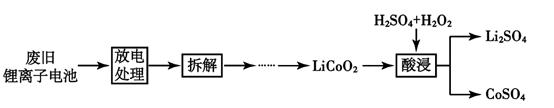
写出酸浸过程中发生反应的化学方程式。
拆解废旧电池前需进行放电处理,既可保证安全又有利于回收锂。有利于回收锂的原因是。
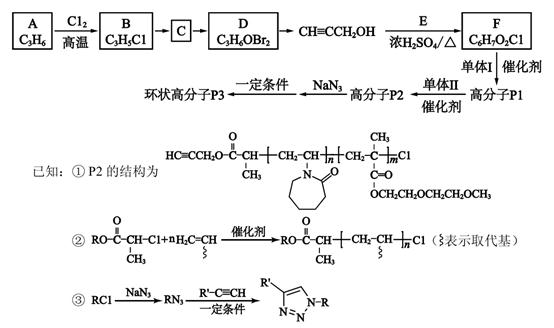
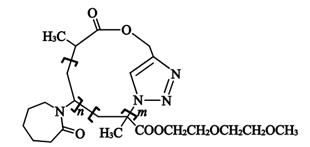
a.F→P1 的反应类型为缩聚反应
b.P3 可能的结构如右图所示
c.P2→P3 的过程中有可能得到线型高分子
d.碱性条件下,P3 可能彻底水解成小分子物质
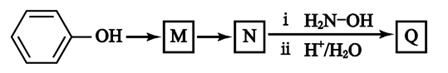
中间体。 下图是以苯酚为原料合成 Q 的流程,M→N 的化学方程式是
ⅰ.称取 5 g 莫尔盐[(NH4)2 Fe(SO4)2·6H2O],用 15 mL 水和几滴 3 mol/L H2SO4 溶液 充分溶解,再加入 25 mL 饱和 H2C2O4 溶液,加热至沸,生成黄色沉淀
ⅱ.将沉淀洗涤至中性,加入 10 mL 饱和 K2C2O4 溶液,水浴加热至 40℃,边搅拌边 缓慢滴加 H2O2 溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸 30 s,加入 8 mL 饱和 H2C2O4 溶液,红褐色沉淀溶解,趁热过滤, 滤液冷却后,析出翠绿色晶体,过滤、干燥。
Ⅱ.测定产品中铁的含量
ⅳ.称量 x g 制得的样品,加水溶解,并加入稀 H2SO4 酸化,再滴入 y mol/L KMnO4溶液使其恰好反应;
ⅴ.向ⅳ的溶液中加入过量 Zn 粉,反应完全后,弃去不溶物,向溶液中加入稀 H2SO4酸化,用 y mol/L KMnO4 溶液滴定至终点,消耗 KMnO4 溶液 z mL。
已知:H2C2O4 为二元弱酸,具有较强的还原性
6 FeC2O4·2H2O ++= 4 [Fe(C2O4)3]3- + 2 Fe(OH)3↓ +H2O

补全 Na 与水反应的实验现象:。
资料:Mg 水反应时,Mg 表面覆盖了致密的 Mg(OH)2 导致反应缓慢;NH4+ 和 HCO3-可以加快 Mg 与水反应。
同学们为了验证 NH4+ 和 HCO3-对 Mg 与水反应的促进作用,用与水反应后的 Mg条与 4 种盐溶液进行对比实验,结果如下
实验序号 | a | b | c | d |
盐溶液(均为 0.1 mol/L) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
溶液起始 pH | 5.1 | 8.3 | 7.0 | 7.8 |
30min 时产生气体体积(mL) | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | H2 | |||
30min 时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
① 根据 Mg(OH)2 的溶解平衡可解释 NH4+ 和 HCO3- 的作用。Mg(OH)2 的溶解平衡表达式是。
② 经检验,a中还生成少量其他气体,可进一步证明 NH4促进 Mg与水反应。检验该气体的方法是。
③ 上表中能够说明 HCO3-对 Mg 与水反应起促进作用的证据是。
④ b、d 所得固体中还检验出碱式碳酸镁[用 Mg2(OH)2CO3 表示],写出生成该固体的离子方程式。
综合实验 a~d 可以得到的结论是: NH4+ 和 HCO3-都能与 Mg(OH)2 作用加快 Mg与水反应,(补充两点)。