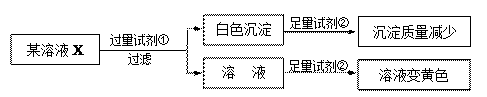

下列说法不正确的是:( )
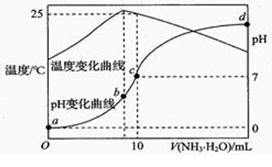

补全 Na 与水反应的实验现象:。
资料:Mg 水反应时,Mg 表面覆盖了致密的 Mg(OH)2 导致反应缓慢;NH4+ 和 HCO3-可以加快 Mg 与水反应。
同学们为了验证 NH4+ 和 HCO3-对 Mg 与水反应的促进作用,用与水反应后的 Mg条与 4 种盐溶液进行对比实验,结果如下
实验序号 | a | b | c | d |
盐溶液(均为 0.1 mol/L) | NH4Cl | NaHCO3 | NaCl | NH4HCO3 |
溶液起始 pH | 5.1 | 8.3 | 7.0 | 7.8 |
30min 时产生气体体积(mL) | 1.5 | 0.7 | <0.1 | 1.4 |
气体的主要成分 | H2 | |||
30min 时镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||
① 根据 Mg(OH)2 的溶解平衡可解释 NH4+ 和 HCO3- 的作用。Mg(OH)2 的溶解平衡表达式是。
② 经检验,a中还生成少量其他气体,可进一步证明 NH4促进 Mg与水反应。检验该气体的方法是。
③ 上表中能够说明 HCO3-对 Mg 与水反应起促进作用的证据是。
④ b、d 所得固体中还检验出碱式碳酸镁[用 Mg2(OH)2CO3 表示],写出生成该固体的离子方程式。
综合实验 a~d 可以得到的结论是: NH4+ 和 HCO3-都能与 Mg(OH)2 作用加快 Mg与水反应,(补充两点)。
①加入固体AgNO3 , 则c(I-)(填“变大”、“ 变小”或“不变”,下同),c(Ag+) 。
②若改加更多的AgI,则c(Ag+)将。
③若改加Na2S固体,则c(I-),c(Ag+)。
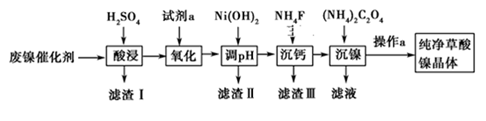
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
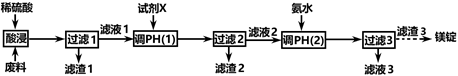
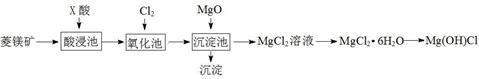
为了提高产品纯度,试剂X宜选择()(填代号)。
A.CuO
B.MgO
C.MgCO3
D.氨水