| 选项 | A | B | C | D |
| 名称 | 250 mL容量瓶 | 分液漏斗 | 酸式滴定管 | 冷凝管 |
| 图形 | | | | |
| 用途与使用操作 | 配制1.0 mol·L-1NaCl溶液,定容时仰视刻度,则配得的溶液浓度小于1.0 mol·L-1 | 用酒精萃取碘水中的碘,分液时,碘层需从上口放出 | 可用于量取10.00mL Na2CO3溶液 | 蒸馏实验中将蒸气冷凝为液体 |
 B . 分离沸点相差较大的互溶液体混合物
B . 分离沸点相差较大的互溶液体混合物  C . 容量瓶中转移液体
C . 容量瓶中转移液体  D . 分离互不相容的两种液体
D . 分离互不相容的两种液体 


①催化剂和吸水剂②脱水剂
①防止倒吸②有利于气体导出
①降低乙酸乙酯在溶液中的溶解度;
②除去挥发出的乙酸;
③溶解挥发出的乙醇。
a.天平 b.量筒 c.容量瓶 d.滴定管
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
|
相对分子质量 |
熔点/℃ |
沸点/℃ |
密度/g•cm-3 |
溶解性 |
|
|
二苯基羟乙酮 |
212 |
133 |
344 |
1.310 |
不溶于冷水,溶于乙醇 |
|
二苯基乙二酮 |
210 |
97 |
348 |
1.084 |
不溶于水,能溶于乙醇 |

 +2FeCl3
+2FeCl3  +2FeCl2+2HCl
+2FeCl2+2HCl
在反应装置中,加入10mL冰醋酸、5.50g FeCl3固体、10mL水及少量碎瓷片,加热至沸腾,停止加热,待沸腾平息后加入2.12g二苯基羟乙酮,继续加热回流至二苯基羟乙酮完全反应。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯,得到1.80g产品。
重结晶过程如下:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:

该实验条件下加热____后可认为反应结束。
丙炔酸甲酯( CH≡C-COOCH3 )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
![]()
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇(装置见下图)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。



CH3CH2CH2CH2OH CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
若加热后发现未加沸石,应采取的正确方法是。


可能用到的有关数据如下:
| 相对分子质量 | 密度 g/cm3 | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
 B .
B .  C .
C .  D .
D . 
C6H12O6(葡萄糖)=2+ 2 C2H5OH

①试管a中生成乙酸乙酯的化学方程式是。
②试管b中盛放的试剂是饱和溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
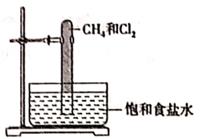
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是(填标号)
A.  B.
B. 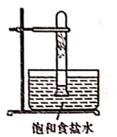 C.
C. 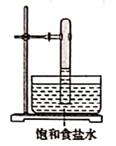 D.
D. 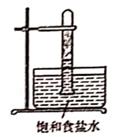
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。

①实验开始时,试管甲中的导管不伸入液面下的原因是;
②上述实验中饱和碳酸钠溶液的作用是;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是。