


|
实验编号 |
反应温度/℃ |
反应时间/h |
反应物物质的量配比n[CO(NH2)2]:n[TiO(OH)2] |
|
① |
90 |
1 |
2:1 |
|
② |
90 |
2 |
3:1 |
|
③ |
90 |
1 |
|
|
④ |
110 |
2 |
3:1 |
实验②和④的实验目的是,实验③中反应物物质的量配比为。

①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH0(填“>”或“<")。
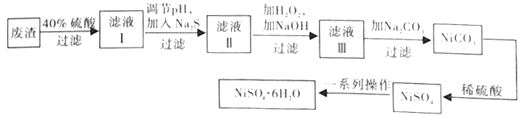
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有。
②向滤液Ⅰ中加入Na2S的目的是。(已知:Ksp[FeS]=6.3×10-18 , Ksp[CuS]=1.3×10-36 , Ksp[ZnS]=1.3×10-24 , Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是(写出一条即可)。
①CO2(g)+2H2O(l) CH3OH(l)+
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l) CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g) CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是,反应进行程度最大的是。
①在载人航天器中利用Sabatier反应实现回收CO2 , 再生O2 , 其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充(填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
| 催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 86.8 | 90.1 |
| Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
| 气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| 10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
| 30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
| 40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
| 50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率(填“增大”或“减小”),其可能的原因是。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为(列出计算表达式)。

a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
|
物质名称 |
Ka1 |
Ka2 |
|
富马酸( | 7.94×10-4 | 2.51×10-5 |
| 马来酸( | 1.23×10-2 | 4.68×10-7 |
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:。

 代替
代替  ,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是。
,则M的产率会由78%降至48%,其原因除了氯原子的反应活性比溴原子低外,还可能是。

回答下列问题:
①化合物X的分子式为。
②写出化合物Q的结构简式。
③写出同时符合下列条件的化合物W的同分异构体的(写出一种即可)。
Ⅰ.能与FeCl3溶液发生显色反应
Ⅱ.苯环上的一氯代物只有一种
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为1:1:2:2:6