 搭建消毒棚
B .
搭建消毒棚
B .  喷药消毒
C .
喷药消毒
C .  穿戴防护服
D .
穿戴防护服
D .  缝制棉被
缝制棉被
①维生素和水都是人体必须的营养素
②豆浆是富含蛋白质的食品
③锌、硒等元素是人体必须的微量元素,应大量服用含有这些元素的营养补剂
④骨头汤中含有钙元素,青少年可经常食用以防患佝偻病
⑤为预防甲状腺肿大,在食盐中添加大量的碘单质

 称量 10.25g 固体
B .
称量 10.25g 固体
B .  测溶液的pH
C .
测溶液的pH
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  蒸发食盐水
蒸发食盐水

 充分燃烧模型
B .
充分燃烧模型
B . 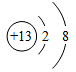 铝离子模型
C .
铝离子模型
C .  氧化反应和化合反应关系
D .
氧化反应和化合反应关系
D .  铁合金含碳量
铁合金含碳量




(查阅资料)①发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉、氯化钠中的若干种组成。②氢氧化镁和氢氧化铝均为不溶于水的白色固体粉末,且后者可溶于NaOH溶液。
(成分探究)取出某品牌的发热包内灰黑色的固体粉末,分成两份。
用磁铁将该物质全部吸出后,剩余粉末为样品A。
猜想二:上述三种同时存在;
猜想三:存在镁粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五:

请写出气体C生成的化学方程式。
(实验结论)大家结合实验现象讨论后,认为猜想五正确。
(回顾旧知)请写出NaOH在空气中变质的化学反应方程式。
(提出问题)白色粉末中含有哪些成分?
(猜想假设)猜想一:Na2SiO3和NaOH;
猜想二:Na2SiO3和Na2CO3
猜想三:
(查阅资料)Na2SiO3 , 化学性质与碳酸钠类似,其水溶液显碱性,可与CaCl2溶液反应。CaCl2溶液呈中性。硅酸钙是难溶于水的白色固体。
(设计实验)
|
实验步骤 |
实验现象 |
解析或结论 |
|
①取少量白色粉末于试 管中完全溶解,并滴入两滴无色酚酞溶液。 |
溶液 |
说明白色粉末的水溶液显碱性 |
|
②向上述溶液中加入足量的CaCl2溶液。 |
有生成,且溶液红色(填“消失”或 “不消失”) |
猜想二成立 |
(实验延伸)该同学用pH计(一种精确测定溶液pH的仪器),测定了上述反应后的废液,结果显示废液pH=7.8,他认为可能是仪器坏了,于是另换仪器重新测定,发现废液pH仍然为7.8,这意味着此时溶液显性,但是酚酞却显示无色。
(反思交流)在向老师讨教后,该同学认识到,原来所有酸碱指示剂都有一定的变色范围。例如酚酞,在pH大于8.2时才会变为红色。据此对酚酞检验后未变色的溶液酸碱性,你有何新的看法?。
