实验内容 | 实验目的 | |
A | 向1 mL 0.1mol/L NaOH溶液中加入2 mL 0.1mol/L CuSO4溶液 , 振荡后滴加0.5 mL葡萄糖溶液,加热未出现红色沉淀 | 证明葡萄糖中含有醛基 |
B | 向1 mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2 溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下, Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 测定同温度下相同浓度的碳酸钠和硫酸钠溶 液的pH,前者大于后者 | 证明碳元素非金 属性弱于硫 |
D | 向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊试 纸置于试管口试纸不变蓝 | 证明溶液中无NH4+ |
设计如下装置探究稀盐酸中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu)。恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa'处形成清晰的界面。通电后,可观察到清晰界面缓缓向上移动。下列说法不正确的是( ) 
乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图
和有关信息如下:

乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |

在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是。
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目是。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应
物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 SO2↑+Cl2↑ |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

方程式为。
①从分解产物中分离出硫酰氯的方法是。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:

已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应。
回答下列问题:
①对C加热的方法是(填序号)。
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、和。
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则1t苯可制得成品为t(只要求列式)。
298 K时,在2L恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如下图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。

①298k时,该反应的平衡常数为。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如下图所示。

下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol 、n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”“<”或“=”)。
NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①水的电离程度最大的是(填“a”“b”“c”“d”或“e”,下同)
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是;
③在c点,溶液中各离子浓度由大到小的排列顺序是。
已知反应CO(g)+2H2(g) ![]() CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下: 
则x=。
在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压
CH3OH(g) ∆H1<0,CO在不同温度下的平衡转化率(α)与压
强的关系如下图所示。

①a、b两点的反应速率:v(a)v(b)(填“>”“<”或“=”)。
②T1T2(填“>”“<”或“=”),原因是。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:I:CO(g)+2H2(g) ![]() CH3OH(g) ∆H1II:CO2(g)+H2(g)
CH3OH(g) ∆H1II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) ∆H2III:CO2(g)+3H2(g)
CO(g) + H2O(g) ∆H2III:CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3
上述反应对应的平衡常数分别为K1、K2、K3 , 它们随温度变化曲线如下图所示。

则∆H1∆H3(填“>”、“<”、“=”), 理由是。
NH3催化氧化可制备硝酸。

①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH2=-1269.02 kJ·mol-1
则4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH3。
②NO被O2氧化为NO2。其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如上图所示。则p1p2(填“>”“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是。
利用反应NO2+NH2―→N2+H2O(未配平)消除NO2的简易装置如下图所示。电极b的电极反应式为;消耗标准状况下4.48 L NH3时,被消除的NO2的物质的量为mol。

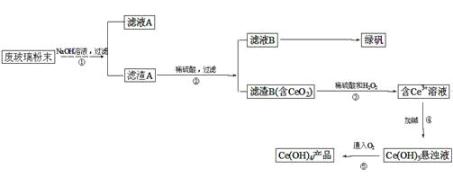
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下:
Cl2及其化合物在生产、生活中具有广泛的用途。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图一所示。

亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2•3H2O;
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
a.将SO2氧化成SO3 , 增强酸性 b.将NaClO3还原为ClO2 c.稀释ClO2以防止爆炸
a.Na2O2 b.Na2S c.FeCl2
a.准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)
b.移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL 。(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
②该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,结果化成最简。)
工业上制取硝酸铵的流程图如下,请回答下列问题:

方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是,缺点是。
海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
利用铜萃取剂M,通过如下反应实现铜离子的富集:

a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是。

硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
下图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。

①该温度是。
②铜原子的配位数是。
叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:

联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3
它的酸性类似于醋酸,微弱电离出H+和N。试回答下列问题:
由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是_____(选填序号)

人造立方氮化硼的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如下图所示,试分析:
①该晶体的类别为晶体。
②晶体中每个N同时吸引个B。
③设该晶体的摩尔质量为M g·mol-1 , 晶体的密度
为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶体
中两个距离最近的B之间的距离为cm。
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显价,B元素的核外电子排布式为。
共价键 | C-C | C-N | C-S |
键能/ kJ·mol-1 | 347 | 305 | 259 |
实验证明:KCl、MgO、CaO、TiN这4种晶体的结构
与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

有机物A~M有如图转化关系,A与F分子中含碳原子数相同,均能与NaHCO3溶液反应,且A中含一个卤素原子,F的分子式为C9H10O2;D能发生银镜反应;M与NaOH溶液反应后的产物,其苯环上一氯代物只有一种.
已知: 
请回答:
伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
回答下列问题:
①能发生银镜反应
②苯环上的一氯代物有两种结构其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为(写结构简式)。
已知: ![]() 。 参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。 参照上述合成路线,设计一条由苯和乙酸为起始原料制备  的合成路线:。
的合成路线:。
辣椒素是辣椒的活性成分,可以预防心脏病,也能缓解肌肉关节疼痛。辣椒素中酯类化合物的结构可以表示为:
 (R为烃基)。其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基)。其中一种辣椒素酯类化合物J的合成路线如下:
已知:
①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰;
②化合物J的分子式为C15H22O4;
③  +H2O
+H2O
回答下列问题:
常用药品羟苯水杨胺,其合成路线如下。回答下列问题:
 已知:
已知: 
A.1 mol羟苯水杨胺最多可以和2mol NaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
① F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是(填代号)。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
② F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有
种;写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式。