 B . 氧气的验满
B . 氧气的验满  C . 取固体药品
C . 取固体药品  D . 稀释浓硫酸
D . 稀释浓硫酸 
 B .
B .  C .
C .  D .
D . 


|
实验操作 |
实验现象 |
实验结论 |
|
|
|
铁的金属活动性比铜强 |
请回答下列问题:
将步骤Ⅲ补充完整。

①由图1给出的信息可知:20℃时,NaCl的溶解度是g。
②从节约能源和提高产率的角度分析,图2中所需水的最佳体积是mL。(提示:水的密度为1g﹒mL-1;产率= ×100%)
③用玻璃棒搅拌的目的是。
a、过滤速度慢
b、滤纸破损
c、部分杂质未经过滤进入滤液
实验一:探究燃烧的条件

如图所示,为证明燃烧需要可燃物,可用玻璃棒分别蘸取蒸馏水和,置于酒精灯火焰上,观察现象。
实验二:探究铁锈性的条件

①试管(填字母)中的铁钉生锈。
②通过对比试管B、C中的现象,可以得出铁生锈需要与接触。

依据图中所给信息,回答下列问题:
①写出该反应的化学方程式:,其基本反应类型是。
②从微观角度分析
a、CO和CO2的组成元素相同,但化学性质不同,其原因是。
b、化学反应前后不变(写一点)。
|
名称 |
甲烷 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
己烷 |
…… |
|
化学式 |
CH4 |
C2H6 |
C3H8 |
C4H10 |
C5H12 |
C6H14 |
…… |
|
碳元素的质量分数 |
75.0% |
80.0% |
81.8% |
82.8% |
83.3% |
83.7% |
…… |
|
1g物质完全燃烧消耗氧气的质量/g |
4.00 |
3.73 |
3.64 |
3.59 |
3.56 |
3.53 |
…… |
分析表中数据,我们可以总结出一些与烷烃相关的变化规律,写出其中的两条:
①随着烷烃分子中碳原子数的增加,碳元素的质量分数逐渐(填“增大”或“减小”)。
②。
如下图所示,同学们设计了不同的实验方案进行探究:
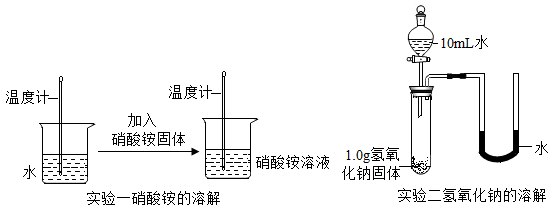
实验一中的硝酸铵溶解后,溶液温度(填“升高”、“降低”或“不变”)。
如下图所示,同学们用氢氧化钠溶液进行了下列实验,请分析并回答下列问题:
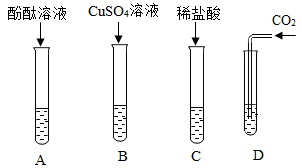
A试管中观察到的现象是。
①为了证明D中已发生化学反应,向该试管中再加入足量的,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)
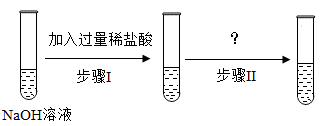
整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。请写出步骤Ⅱ中所加试剂。
实验室中的应用
实验室中能用氢氧化钠溶液吸收的气体是(填字母)。
a、二氧化碳
b、水蒸气
c、氯化氢
d、氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的不同。
氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9t(H2SO4的质量分数为20%),可以处理的废水质量是t。
结合化学方程式中的数据分析:若将等质量、等溶质质量分数的稀硫酸和氢氧化钠溶液混合,充分反应后,请判断溶液中一定含有的溶质,并简述你的判断理由:。