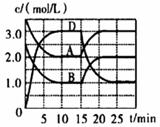
甲 v(Fe)=2.8 g·min-1; 乙 v(H2SO4)=1 mol·L-1·min-1;
丙 v(FeSO4)=0.5 mol·L-1·min-1;
丁 v(H2)=1.12 L·min-1。
下列说法正确的是( )
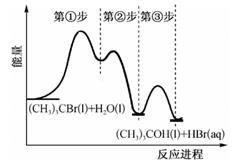
①缩小体积,增大压强②增加碳的量③恒容通入CO2④恒容下充入N2⑤恒压下充入N2
①加H2O②加KNO3溶液③滴入几滴浓盐酸④加入少量铁粉⑤加NaCl溶液⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol/L盐酸
①再加入30 mL 3 mol·L-1盐酸 ②改用30 mL 6 mol·L-1盐酸
③改用3 g粉末状大理石 ④适当升高温度
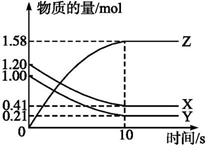
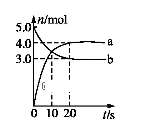
a.恒容时充入Ne b.适当升高温度
c.缩小容器的体积 d.选择高效催化剂
|
时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
0 |
50 |
120 |
232 |
290 |
310 |