B . 高山流水
B . 高山流水  C . 缤纷烟火
C . 缤纷烟火  D . 枫叶变红
D . 枫叶变红 
 B . 量桶
B . 量桶 
 B .
B .  C .
C .  D .
D . 

| A. | 氖气的化学式—Ne 1个硅原子—Si 1个钠离子—Na | B. | 决定元素种类—质子数 决定元素化学性质—最外层电子数 决定元素周期表元素排列顺序—质子数 |
| C. | 铁—由分子构成 二氧化碳—由原子构成 氧化钠—由离子构成 | D. | 分子—化学变化中的最小粒子 原子—保持物质化学性质的最小粒子 离子—带电的原子 |
A 干冰用于人工降雨 B 铜用于制导线 C 氮气用于食品防腐 D 氧气用于医疗急救
①铁丝在氧气中燃烧:
②实验室中氯酸钾分解制取氧气:



【假设猜想】猜想一:相对分子质量越大,分子运动速率越快.
猜想二:,分子运动速率越快.
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】氨分子的分子质量小于氯化氢分子的分子质量,该反应的文字表达式为
|
实验过程 |
冷水 |
热水 |
|
开始 |
红色扩散较快 |
红色扩散较慢 |
|
长久放置 |
最终均成为红色、均匀、透明的液体 |
|
此实验现象得到的结论与老师讲解的结论恰好相反,试从控制变量角度进行分析小组同学操作不足之处是

【作出猜想】猜想一:燃烧产生的CO2使蜡烛熄灭;猜想二:白雾是水雾导致蜡烛熄灭;
小组同学经过讨论,排除了猜想一,其理由是。
【问题2】为什么H2O2溶液的溶质质量分数越大水雾越多呢?
【实验2】分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。
|
H2O溶液 |
5% |
10% |
30% |
|
温度变化曲线 |
|
|
|
【解释与结论】
①该对比实验过程中不需要控制的条件是。
A.H2O2溶液的初始温度相同 B.反应开始的时间相同 C.二氧化锰的质量相同
②根据实验数据说明该反应是(填:“放热反应”或“吸热反应”)
③根据实验探究2,可得出的一个结论是。

①图乙是“0.1克MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出
②图丙是“3% H2O2溶液8毫升与不同质量的MnO2混合”的实验结果,从图中可以看出
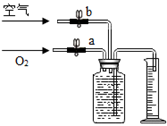
(提示:空气中氧气的体积分数按1/5来计算,集气瓶中氧气的体积=通入的氧气体积+通入的空气中的氧气体积)