| 选项 | 操作 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
| B | 向 KCl、KI 的混合液中逐滴滴加稀 AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 铝片先用砂纸打磨,再加入到浓硝酸中 | 无明显现象 | 浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜 |
| D | 向盛有 H2O2 溶液的试管中加入几滴酸化的硫酸亚铁溶液 | 溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成 | Fe3+催化 H2O2 分解产生 O2 |
①H2A在水溶液中的电离方程式为。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气。
A.盐酸多
B.H2A多
C.一样多
D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为。
①下列微粒可以大量共存的是(填字母)。
a. 、
b.
、
c.
、
d.H2SO3、
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是。
a.两溶液的 pH 相同
b.两溶液的导电能力相同
c.两溶液中由水电离出的 c(OH-)相同
d.中和等物质的量的NaOH,消耗两溶液的体积相同
a. CH3COOH 溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO-)
b. 0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中 c(OHˉ)减小
c. CH3COOH 溶液中加入少量 CH3COONa 固体,平衡逆向移动
d. 常温下,pH=2 的 CH3COOH 溶液与 pH=12 的 NaOH 溶液等体积混合后溶液的 pH>7
e.室温下 pH=3 的醋酸溶液加水稀释,溶液中 不变
① 醋酸在水溶液中的电离方程式为。
② 下列方法中,可以使醋酸稀溶液中 CH3COOH 电离程度增大的是(填字母序 号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
Ⅱ.用 0.1 mol·L-1 NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1 的盐酸和醋酸溶液,得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
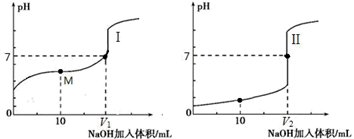
①滴定醋酸的曲线是(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的 c(H+)最大的是。
③ V1 和 V2 的关系:V1V2(填“>”、“=”或“<”)。
④ M 点对应的溶液中,各离子的物质的量浓度由大到小的顺序是。
|
操作步骤 |
现象 |
|
步骤 1:向 2 mL 0.005 mol·L-1 AgNO3 溶液中加入 2 mL 0.005 mol·L-1 KSCN 溶液,静置。 |
出现白色沉淀。 |
|
步骤 2:取 1 mL 上层清液于试管中,滴加 1 滴 2 mol·L-1Fe(NO3)3 溶液。 |
溶液变红色。 |
|
步骤 3:向步骤 2 的溶液中,继续加入 5 滴 3 mol·L-1 AgNO3溶液。 |
现象 a ,溶液红色变浅。 |
|
步骤 4:向步骤 1 余下的浊液中加入 5 滴 3 mol·L-1 KI 溶液。 |
白色沉淀转化成黄色沉淀。 |
① 写出步骤 2 中溶液变红色的离子方程式。
② 步骤 3 中现象 a 是。
③ 用化学平衡原理解释步骤 4 的实验现象。
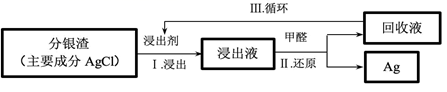
过程 I 的主要反应:AgCl+2
+Cl-
过程 II 的离子反应:4 +6OH- +HCHO=4Ag++8
+4H2O+
Ⅲ中回收液可直接循环使用,但循环多次后,I 中的银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:。
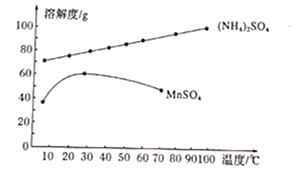
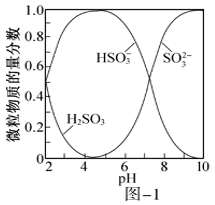
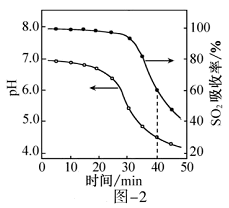
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。
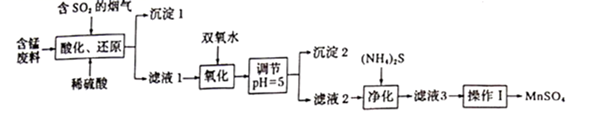
25℃时,几种金属离子沉淀时的pH如下:
| | | | | | |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 | 5.9 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 | 6.9 |