| A | B | C | D |
| | | | |
| 水力发电 | 风力发电 | 铅蓄电池放电 | 太阳能发电 |





①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4eˉ=4OHˉ;
③放电时溶液中的阳离子向正极移动;
④负极的电极反应式为:CH4+10OHˉ-8eˉ= +7H2O;
⑤电子迁移方向:通入CH4的铂电极→通入O2的铂电极→电解质溶液→通入CH4的铂电极
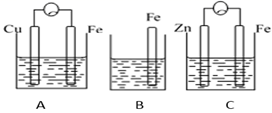

②假如Zn的消耗速率为2×10-3 mol·s-1 , 计算K+的迁移速率。
回答下列问题:

①反应过程中反应物的总能量 (填“>”“<”或“=”)生成物的总能量。
②H2S完全燃烧的化学方程式为 。

①该装置将 能转化为 能。
②已知正极反应式 O2+2H2O+4e- =4OH- ,则负极反应式为 ,右室电解质溶液的pH (填“变大”“减小”或“不变”)。

请回答下列问题:
①电解质溶液X是;电解质溶液Y是。
②写出两电极的电极反应式:铁电极:;碳电极:。
③外电路中的电子是从电极流向电极。(填“铁”或“碳”)
④盐桥中向X溶液中迁移的离子是(填字母):A.K+ B.NO3-
①原电池装置图:;
②正极:;
③负极:。

|
阳离子 |
u∞×108/(m2·s−1·V−1) |
阴离子 |
u∞×108/(m2·s−1·V−1) |
|
Li+ |
4.07 |
|
4.61 |
|
Na+ |
5.19 |
|
7.40 |
|
Ca2+ |
6.59 |
Cl− |
7.91 |
|
K+ |
7.62 |
|
8.27 |