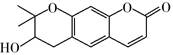
 可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
|
气体(杂质) |
方法 |
|
|
A |
SO2(H2S) |
通过酸性高锰酸钾溶液 |
|
B |
Cl2(HCl) |
通过饱和的食盐水 |
|
C |
N2(O2) |
通过灼热的铜丝网 |
|
D |
NO(NO2) |
通过氢氧化钠溶液 |

下列说法错误的是( )

下列叙述正确的是( )

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
|
金属离子 |
Fe3+ |
Fe2+ |
Al3+ |
Mn2+ |
|
开始沉淀pH |
1.9 |
7.0 |
3.0 |
8.1 |
|
完全沉淀pH |
3.2 |
9.0 |
4.7 |
10.1 |
回答下列问题:

|
阳离子 |
u∞×108/(m2·s−1·V−1) |
阴离子 |
u∞×108/(m2·s−1·V−1) |
|
Li+ |
4.07 |
|
4.61 |
|
Na+ |
5.19 |
|
7.40 |
|
Ca2+ |
6.59 |
Cl− |
7.91 |
|
K+ |
7.62 |
|
8.27 |



曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。

电池充电时,LiFeO4脱出部分Li+ , 形成Li1−xFePO4 , 结构示意图如(b)所示,则x=,n(Fe2+ )∶n(Fe3+)=。

已知如下信息:
①H2C=CH2
![]()
② ![]() +RNH2
+RNH2
![]()
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题: