 B . 稀释浓硫酸
B . 稀释浓硫酸  C . 过滤
C . 过滤  D . 判断酸和碱能否反应
D . 判断酸和碱能否反应 
体液 | 尿液 | 胃液 | 血液 |
pH | 4.7~8.4 | 0.9~1.5 | 7.35~7.45 |
根据上表可知,在正常情况下( )
 B .
B . 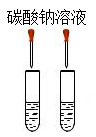 C .
C .  D .
D . 

|
试管内物质 |
胶头滴管内物质 |
|
|
A |
氢氧化钠固体 |
水 |
|
B |
氧化铁 |
稀盐酸 |
|
C |
氯化钡溶液 |
稀硫酸 |
|
D |
二氧化碳 |
氢氧化钠溶液 |



 B .
B .  C .
C .  D .
D . 

|
烧杯中的物质 |
x溶液 |
|
|
A |
碳酸氢钠和氯化钠溶液 |
稀HCl |
|
B |
HCl和FeCl3溶液 |
NaOH溶液 |
|
C |
碳酸钠和碳酸钙 |
稀HCl |
|
D |
稀盐酸和稀硫酸 |
BaCl2溶液 |
①;②;③

![]()
![]()
![]()
| 清洁剂名称 | 洁厕灵 | 彩漂液 | 漂白水 |
| 功能 | 清除污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 漂除衣物污渍 |
| 有效成分 | HCl | H2O2 | NaClO |
根据表中信息,回答下列问题。

|
实验内容 |
⑴将此固体加入足量水中 |
⑵向过滤后所得的白色沉淀中加入稀硝酸,出现下列②、③、④三种情况,请分别讨论: |
||
|
实验现象 |
得到白色沉淀,上层清液呈蓝色 |
②若沉淀完全溶解 |
③若沉淀不溶解 |
④ 若沉淀部分溶解 |
|
实验结论 |
该 粉 末 中 一 定 含 有 |
该粉末中一定不含 |
该粉末中可能含有 |
该粉末中一定含有 |
⑴做出假设;
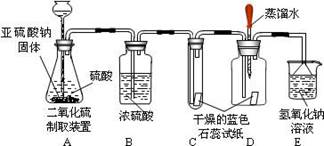
⑵设计方案,实验装置和药品如图:
⑶查阅资料:该实验小组查阅到:①二氧化硫易溶于水,②酸能使湿润的蓝色石蕊试纸变红,③SO2不与浓硫酸反应,④二氧化硫有毒,能与氢氧化钠溶液反应。
⑷实验:①在二氧化硫气体生成之前,装置 D 中胶头滴管中的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,这说明。
② 实验过程中当有二氧化硫气体通过时, 装置 C 内石蕊试纸的颜色始终没有变化, 此现象说明;装置 D 内滴入蒸馏水的石蕊试纸变红,此现象说明。
③装置 E 的作用是
⑸结论。
|
实验操作 |
实验现象 |
结论 |
|
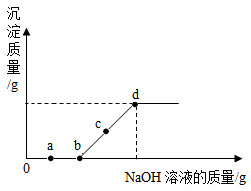
往盛有NaOH溶液的试管中通入CO2 , 然后滴入足量的CaCl2 |
|
CO2与NaOH 溶液发生了反应 |
|
实验操作 |
实验现象 |
结论 |
|
打开活塞,挤压滴管 |
|
CO2 与 NaOH 溶液发生了反应 |
Ⅰ.同学们作出猜想
猜想一:是小水滴。因为盐酸溶液中的水受热会汽化上升,在试管口(填物态变化名称)成小水滴。 猜想二:是盐酸小液滴。可能是因为同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小金提出质疑:为什么刚才打开盛放盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾? 小金联系反应时试管外壁很烫,于是猜想:白雾的形成可能与温度有关。
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后。(填操作和现象) 得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
10%,具体是什么物质无法辨认。老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠 中的一种。
|
实验步骤 |
实验现象 |
实验结论 |
|
取少量溶液于试管中,滴加。 |
|
该溶液是碳酸钠溶液。 |
【实验反思】小惠经过反思,向同学们提出如下建议,你认为合理的是(填序号)。
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留
②Cl-对反应无影响,SO42-能抑制铝片和稀酸反应。
③Cl-能促进铝片和稀酸的反应,SO42-能抑制铝片和稀酸的反应。
|
组别 |
1 |
2 |
|
相同的铝片 |
1 克铝片 |
1 克铝片 |
|
H+浓度相同的酸 |
5 毫升盐酸 |
5 毫升硫酸 |
|
反应片刻后添加少量某试剂 |
Na2SO4 |
NaCl |
|
添加试剂后的反应现象 |
无明显变化 |
明显加快 |
|
结论 |
和对反应无影响 |
对反应有促进作用 |
根据上述探究过程,请回答下列问题:将表格中的空白处补充完整。

①在锥形瓶中加入质量为 m 的海螵蛸粉末,向分液漏斗中加入稀盐酸。在烧杯中加入足量氢氧化钠溶液,并称量烧杯及氢氧化钠溶液总质量 m1。
②先打开止水夹,再打开分液漏斗活塞,滴加盐酸并及时关闭活塞。完全反应后, 再次称量烧杯及其中液体的总质量 m2



|
实验 |
1 |
2 |
3 |
4 |
|
加样品的质量(g) |
5 |
10 |
15 |
20 |
|
生成 CO2 的质量(g) |
1.76 |
3.52 |
4.4 |
m |
问: