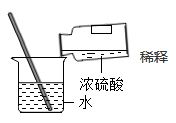
 稀释
B .
稀释
B .  取药
C .
取药
C .  称量
D .
称量
D . 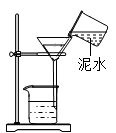 过滤
过滤

| 选项 | A | B | C | D |
| 实验目的 | 除去粗盐中的难溶性杂质 | 测定空气中氧气含量 | 验证甲烷燃烧产生水 | 除去CO中的CO2 |
| 实验装置 或操作 | 将粗盐研碎、溶解、 过滤、蒸发 | | | |


A 混合物 B 纯净物 C 化合物 D 氧化物
苹果富含多种微量元素和维生素等人体所需的营养成分,有健脾开胃、补心益气的作用。常吃苹果还可以帮助降低胆固醇,提高免疫力。
表1 某苹果的主要营养成分(每100 g)
|
营养成分 |
糖类/g |
脂肪/g |
蛋白质/g |
维生素A/mg |
维生素C/mg |
钾/g |
钙/g |
铁/mg |
|
含量 |
16.21 |
0.17 |
0.26 |
3 |
4 |
0.12 |
0.04 |
0.6 |
食用苹果时,应避免食用果核部分。因苹果籽中含有氰苷,氰苷在人体中易转化为剧毒物质氢氰酸(HCN)。苹果加工时容易褐变,影响外观、风味,还会造成营养流失。褐变主要是由于苹果中的酚类化合物在多酚氧化酶的催化下被氧化,因此,对于苹果中多酚氧化酶的特性研究就显得尤为重要(温度对富士苹果中多酚氧化酶相对活性的影响见图)。研究发现柠檬酸能较好地抑制苹果中多酚氧化酶的相对活性。

依据文章内容,回答下列问题:
A 苹果营养丰富,适量食用有益健康
B 高胆固醇人群不宜食用苹果
C 表1中的钾指的是钾元素
D 苹果中维生素C的含量高于蛋白质


② Zn + FeSO4 =ZnSO4 + Fe
③ Zn + 2HCl = ZnCl2 + H2↑
反应①~③中,化合价发生改变的元素有。

| A | B |
| ⑴用高锰酸钾制取氧气,发生装置应选取(填序号),该反应的化学方程式为。 ⑵用C装置收集氧气时,验满的操作是。 | ⑴用过氧化氢和二氧化锰制取氧气,发生装置应选取(填序号),该反应的化学方程式为。 ⑵可用E装置收集氧气的原因是。 |




| 序号 | 目的 | 步骤或现象 |
| A | 鉴别NaCl溶液和Na2CO3溶液 | ①试管1、2中分别加入两种溶液;②再向两支试管中加入。 |
| B | 比较。 | ①试管1中加入一粒碘和5mL水;②试管2中加入一粒碘和5mL汽油。观察到1中固体几乎不溶解,2中固体全部溶解。 |
| C | 比较锌、铁、铜的金属活动性 | ①试管1中加入ZnSO4溶液,试管2中加入CuSO4溶液; ②再分别向两支试管中插入铁丝。观察到的现象是。 |

在白色点滴板孔穴1、3中加入紫色石蕊溶液,观察到溶液变色。
|
实验 |
实验试剂 |
实验现象 |
|
1 |
锈蚀铁钉+10 mL 稀盐酸 |
生成无色气泡,铁锈较快消失,溶液颜色变黄。 |
|
2 |
锈蚀铁钉+10 mL 稀硫酸 |
生成无色气泡,铁锈减少速度缓慢,溶液颜色未变黄。 |
(提出问题)实验1、2现象不同的原因是什么?
(查阅资料)HCl在水中会解离出H+和Cl- , H2SO4在水中会解离出H+和SO42-。
(假设猜想)可能和溶液中阴离子不同有关。
(进行实验)
|
实验 |
实验试剂 |
实验现象 |
|
3 |
锈蚀铁钉+10 mL稀硫酸 + _A_ |
生成无色气泡,铁锈减少速度比实验2快,溶液颜色变黄。 |
|
4 |
锈蚀铁钉+10 mL稀盐酸 + Na2SO4 |
生成无色气泡,铁锈减少速度比实验1慢,溶液颜色变黄。 |
(解释和结论)
铁锈(主要成分为Fe2O3)和盐酸反应的化学方程式是。