①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解. 分析上面实验得出的结论中,正确的是( )


序号 | 实 验 | 现 象 |
A | 将氢氧化钠固体放在表面皿上,放置一会儿 | 固体受潮,逐渐溶解 |
B | 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 | 溶液变红 |
C | 向盛有氢氧化钠溶液的试管中滴加稀盐酸 | 有氯化钠生成 |
D | 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 | 产生蓝色沉淀 |
 B .
B .  C .
C .  D .
D . 

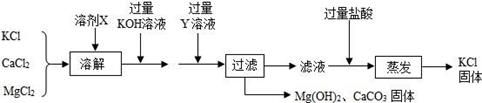

①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液。
②取少量上述溶液,加过量稀硫酸,有气泡产生。
③取②中所得溶液少量,滴加BaCl2 溶液,产生白色沉淀。分析上述现象,对原固体组成的推断正确的是( )
②该同学接着又将试管B和试管D中的物质也倒入该烧杯内,他测定烧杯内所得液体的pH为2, 其测定的操作方法是, 通过这一测定结论可分析烧杯最终所得溶液中的溶质种类有种.
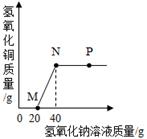
②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生. 据此推断,该白色粉末中一定含有;一定不含有.




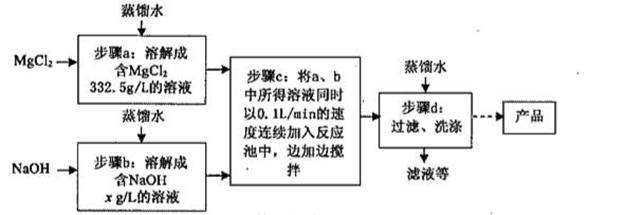
①盐酸 ②氯化钙 ③氨水 ④硫酸镁
【提出问题】①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
⑴Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3 +O2=2Na2SO4;
⑵Na2SO3 能与酸反应产生 SO2 气体;
⑶ 、
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想 1:没有变质,成分是 Na2SO3; 猜想 2:完全变质,成分是 Na2SO4;
你认为还可能有的猜想 3:。
【实验探究 I】甲、乙两组分别进行实验探究溶液是否变质:
|
小组 |
实验操作 |
现象 |
结论 |
|
甲组 |
取少量样品于试管中加入过量稀盐酸; |
产生气泡 |
没有变质,还是 Na2SO3 |
|
乙组 |
取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 |
|
已部分变质 |
【评价】有同学质疑甲组方案不合理,理由是。
评价:Na2SO3部分变质时,加稀盐酸也会产生气体
【实验探究 II】

甲组设计如下实验测定Na2SO3 溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
⑴连好装置并检查装置气密性,在锥形瓶中放入 126g 该样品;
⑵实验前称量C 装置的质量;
⑶关闭活塞 K,用注射器推入浓硫酸至不再产生气泡;
⑷打开活塞 K,缓缓鼓入一定量的氮气,关闭活塞 K;
⑸再次称量 C 装置的质量发现比反应前增重 6.4g。
由此,计算出该溶液中Na2SO3 的质量分数为;
【解释】若没有进行第 4 步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的(填“偏 小”或“偏大”)。

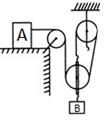
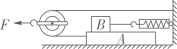
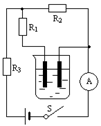
甲小组按照实验要求在滑轮上挂上钩码,竖直向上拉弹簧测力计,每次都匀速提起钩码,如图(a)所示。乙、丙两个小组的同学实验时,没有注意按照要求规范操作,他们斜向上拉弹簧测力计,匀速提起钩码,实验情况分别如图(b)、(c)所示。各小组的实验数据记录在表格中。
| 表一(甲小组) | 表二(乙小组) | 表三(两小组) | ||||||
| 实验序号 | 物体的重力(牛) | 弹簧测力计的示数(牛) | 实验序号 | 物体的重力(牛) | 弹簧测力计的示数(牛) | 实验序号 | 物体的重力(牛) | 弹簧测力计的示数(牛) |
| 1 | 1.0 | 0.6 | 4 | 1.0 | 0.7 | 7 | 1.0 | 0.8 |
| 2 | 2.0 | 1.1 | 5 | 2.0 | 1.3 | 8 | 2.0 | 1.6 |
| 3 | 3.0 | 1.6 | 6 | 3.0 | 1.8 | 9 | 3.0 | 2.3 |
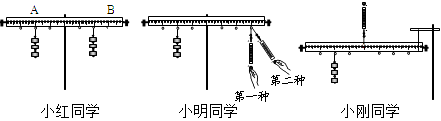
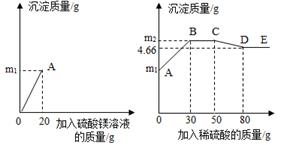
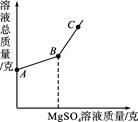
①上述过程中产生氢气的质量是 ;
②10g 该合金中铜的质量,已知反应后溶液中溶质全部溶解,求该溶液中溶质的质量分数为;
|
次序 |
G/N |
F/N |
h/m |
s/m |
W 有用/J |
W 总/J |
η |
|
1 |
2 |
2.1 |
0.1 |
0.1 |
0.2 |
0.21 |
95.2% |
|
2 |
2 |
1.2 |
0.1 |
0.2 |
0.2 |
0.24 |
83.3% |
|
3 |
2 |
0.9 |
0.1 |
0.3 |
0.2 |
0.27 |
★ |