 B .
B .  C .
C .  D .
D . 
 B . 加热液体
B . 加热液体  C . 量取液体
C . 量取液体  D . 吸取液体
D . 吸取液体 


| A | B | C | D | |
| X | 化合反应 | 纯净物 | 化合物 | 化学反应 |
| Y | 氧化反应 | 混合物 | 氧化物 | 化合反应 |
| A.化学与技术 | B.化学与能源 |
| ①用钛镍形状记忆合金制成人造卫星天线 ②用扫描隧道显微镜获得苯分子图像 ③用催化净化装置促进汽车尾气中有害气体的转化 | ①氢能源是一种广泛使用的能源 ②可燃冰将成为未来新能源 ③倡导大量使用高硫煤做燃料 |
| C.化学与医药 | D.化学与食品 |
| ①用氧气进行医疗急救 ②用生石灰做补钙剂 ③用干冰作血液制品冷藏运输的致冷剂 | ①霉变的大米洗净烧熟后可以食用 ②利用甲醛水溶液浸泡水产品防腐 ③补充维生素A防止夜盲症 |
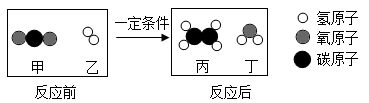
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 40 | 3 | 10 | 15 |
反应t时刻的质量/g | 23 | 19 | a | |
反应后的质量/g | x | y | 28 | 31 |
 用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气
B .
用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气
B .  一定质量的红磷在密闭容器中燃烧
C .
一定质量的红磷在密闭容器中燃烧
C .  向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
D .
向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
D .  加热一定量高锰酸钾制氧气
加热一定量高锰酸钾制氧气
请回答下列问题

a 反应中氧气的物理性质发生了变化
b 此时得到的气体一定是混合物
c 只加热氯酸钾,若生成的气体无气味,说明刺激性气味一定与二氧化锰有关
d 可能是生成的氧气与残留在发生装置中的空气在加热的条件下反应生成了新物质。

[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
①自然界中铁的氧化物主要是Fe3O4(黑色)和Fe2O3(红褐色)两种[FeO(黑色)极易被氧化为Fe2O3];
②铁的氧化物均能溶于盐酸或硫酸的溶液。
③铁单质也能与盐酸或硫酸的溶液反应,生成氢气。
[查阅资料2]
①Fe3O4和Fe2O3的分解温度、铁的熔点见表:
|
Fe3O4 |
Fe2O3 |
铁 |
|
|
分解温度/℃ |
1538 |
1400 |
|
|
熔点/℃ |
1535 |
②Fe2O3高温时分解成Fe3O4。
[理论探讨]根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
①实验中为了防止集气瓶炸裂,必须;
②Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的文字表达式;
③有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色,就说明包装盒破损进气,这样售货员就能及时发现并处理。
查阅资料得知:①通常情况下,甲烷是一种无色无味难溶于水的气体,密度比空气小;
②实验室常用无水醋酸钠(CH3COONa)和碱石灰(发生反应的是其中的氢氧化钠)两种固体药品,研磨均匀混合,通过加热制取甲烷,同时还生成碳酸钠。

在实验室中:
可用于制取甲烷的发生装置为(填字母)。
用装置F收集了一瓶纯净的甲烷气体,在装置G中进行燃烧实验。
可用水将F中气体压出,通入G中,那么,水应从端(填“a”或“b”)注入。
尿素[CO(NH2)2]是一种常用氮肥。下图是利用甲烷制尿素的主要流程:

设备Ⅰ中分离氮气和氧气的过程发生了(填“物理变化”或“化学变化”)。
步骤1 取橙汁样品,加入活性炭,振荡、静置、过滤,滤液移至小烧杯中,盖上玻璃片.
步骤2 配制碘(I2)溶液,测得其浓度为1.27g/L(即1升碘溶液中含有1.27克I2).
步骤3 快速移取20.00mL处理后的橙汁样品置于锥形瓶中,滴入碘溶液,恰好完全反应时消耗碘溶液10.00mL.(测定原理:C6H8O6+I2═C6H6O6+2HI)
①步骤1中活性炭的作用是.
②步骤3必须在步骤1、步骤2之后立即进行的原因是.
③计算1L该橙汁样品中含有维生素C的质量:g.(请写出计算过程)

a.维生素C由C,H,O三种元素组成
b.维生素C的相对分子质量为176g
c.维生素C由6个碳原子、8个氢原子和6个氧原子构成
d.维生素C中C,H,O元素的质量比为9:1:12
相关数据如表:
|
物品 |
反应前 |
反应后 |
||
|
锥形瓶 |
蒸馏水 |
维C泡腾片 |
锥形瓶及瓶内所有物质 |
|
|
质量/g |
71.75 |
50.00 |
4.00 |
125.53 |
①根据以上数据计算本品中碳酸氢钠的质量分数(写出计算过程,结果精确到0.1%)。
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是。