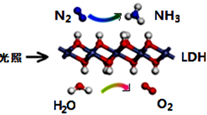

| A | B | C | D | |
| 勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
| 实 验 方 案 | | | | |
| 结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
| 选项 | 实验目的 | 实验方案 |
| A | 探究温度对反应速率的影响 | 2支盛有5 mL相同浓度Na2S2O3溶液的试管分别放在不同温度的水槽中,分别向其中加入5mL相同浓度的稀硫酸溶液,观察现象 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后滴加KSCN溶液观察溶液是否变红 |
| C | 配制480mL0.2mol∙L-1CuSO4 | 将25.0 g CuSO4∙5H2O固体加入蒸馏水中配制成500mL溶液 |
| D | 探究碳酸钠溶液中存在水解平衡 | 向一定浓度的Na2CO3溶液滴入酚酞试液,溶液变红,然后滴加BaCl2溶液,可观察到溶液颜色逐渐变浅直至消失 |
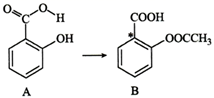
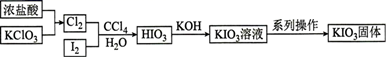
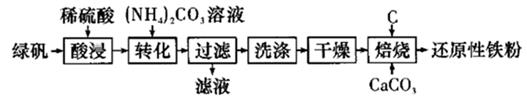
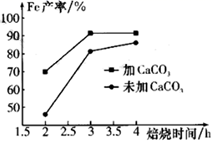
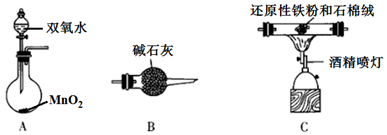
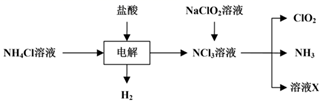
①电解时发生反应的化学方程式为。
②溶液X中大量存在的阴离子有。
a 明矾 b 碘化钾 c 盐酸 d 硫酸亚铁
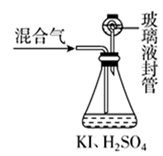
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;(ClO2+I-+H+ → I2+H2O+Cl-)
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用 0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O =2I-+S4O
)指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①玻璃液封装置的作用是。
②测得混合气中ClO2的质量为g(写出计算过程)。
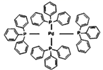 )是一种常见的钯催化剂,也是一种配合物,其配位数为,其中“三苯基膦”中磷原子与键合的三个碳原子构成的立体结构为 。
)是一种常见的钯催化剂,也是一种配合物,其配位数为,其中“三苯基膦”中磷原子与键合的三个碳原子构成的立体结构为 。
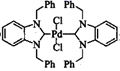 是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为。配体中碳原子的杂化类型有,其中氯原子的价电子轨道表达式为。
是苯并咪唑类卡宾化合物之一(-Ph代表苯基),常用作有机合成的催化剂,其晶体类型为。配体中碳原子的杂化类型有,其中氯原子的价电子轨道表达式为。
反应Ⅱ:
写出200℃时,肼分解为氮气和氢气的热化学方程式:。
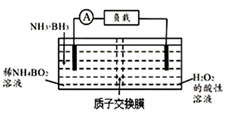
①负极电极反应式为。
②工作足够长时间后,若左右两极质量差为3.8g,则电路中转移电子的物质的量为。

①属于α-氨基酸;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有6种不同化学环境的氢。
 的合成路线流程图(无机试剂任选,合成路线流程图的示例见本题题干)。
的合成路线流程图(无机试剂任选,合成路线流程图的示例见本题题干)。