 B .
B .  D .
D .  D . HCl的电子式:
D . HCl的电子式: 


①将X加入足量水,得到不溶物Y 和溶液Z
②取少量Y加入足量浓盐酸,加热,产生黄绿色气体,并有少量红色不溶物
③用玻璃棒蘸取溶液Z滴于广范pH试纸上,试纸呈蓝色
④向Z溶液中滴加AgNO3溶,生成白色沉淀
分析以上实验现象,下列结论正确的是( )

a.石油裂解是工业上大量获得烃A的主要方法
b.相同条件下,有机物B与钠反应比水与钠反应更剧烈
c.用浓NaOH溶液可除去混在乙酸乙酯中的B、D杂质
d.有机物A与D在一定条件下生成乙酸乙酯的反应属于加成反应




反应②是(填“吸热”或“放热”)反应。

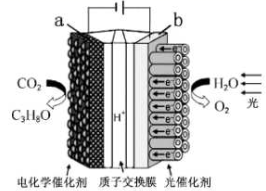
请写出加入(通入)a物质一极的电极反应式;
反应①:C(s)+H2O(g)⇌CO(g)+H2(g) Δ H1=+ 131.3kJ·mol -1
反应②:CO(g)+2H2(g)⇌CH3OH(g) Δ H2
反应③:2CH3OH(g)⇌CH3OCH3(g)+H2O(g) Δ H3=- 23.9 kJ·mol -1
反应④: CH3OCH3(g)⇌C2H4(g)+H2O(g) Δ H4=- 29.1kJ·mol -1
反应①能自发进行的条件是(填“高温”或“低温”)。

2CH3OH(g)⇌C2H4(g)+2H2O(g) Δ H = kJ·mol -1
