 铝土矿炼铝
B .
铝土矿炼铝
B .  天然气燃烧
C .
天然气燃烧
C .  木材制桌椅
D .
木材制桌椅
D .  海水提取镁
海水提取镁

 过滤
B .
过滤
B .  氢气验纯
C .
氢气验纯
C .  收集氧气
D .
收集氧气
D .  塞紧橡皮塞
塞紧橡皮塞


| 编号 | 事实 | 结论 |
| A | 某气体使燃着的木条熄灭 | 该气体一定是氮气 |
| B | 干冰升华为气体 | 二氧化碳分子变大 |
| C | 稀有气体的性质稳定 | 其原子已达到相对稳定结构 |
| D | 某物质组成中只含有一种元素 | 该物质一定是单质 |



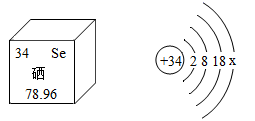
①表中氟原子的原子结构示意图中x为,上述元素在周期表中为于同一周期的原因是,②镁原子的结构示意图为  ,上图中与其化学性质相似的元素是。
,上图中与其化学性质相似的元素是。

①工业上一般采用甲路径分离净化后的液态空气制取氧气,在生产中应控制温度的范围是;(已知在1.01×105Pa时,O2的沸点为-183℃,N2的沸点为-196℃)
②食盐水常通过乙、丙、丁三种路径来制取氧气,写出装置B中a仪器的名称;若用路径戊,应选择的发生装置是(填序号);若用路径丙发生反应的文字表达式是;
交流反思:控制反应条件可以促进或抑制化学反应,请写出促进可燃物燃烧的方法(写出一种);
|
编号 |
河段 |
水质类别 |
主要污染指标 |
质量状况 |
|
① |
长江芜湖弋矶山河段 |
Ⅱ |
良好 |
|
|
② |
裕溪河裕溪闸段 |
Ⅳ |
汞 |
一般 |
|
③ |
南淝河合肥新港河段 |
劣Ⅴ |
总磷、氨氮 |
很差 |


(提出问题)呼出气体中有哪些主要成分,它们的含量是多少?
(假设与猜想)呼出气体中N2、O2、CO2、水蒸气等
(查阅资料)氢氧化钠(NaOH)溶液可以充分吸收CO2
(实验1)验证含有水蒸气

|
实验操作 |
主要实验现象 |
实验结论及解释 |
|
|
① |
检查装置气密性冰箱装置中加药品 |
略 |
略 |
|
② |
打开a、b,向B中缓慢压入500mL呼出气体后关闭a |
B中液体沿导管流入C中,C中液体为475mL |
呼出气体中二氧化碳为mL |
|
③ |
关闭a、b,用凸透镜聚光引燃白磷 |
白磷燃烧产生大量白烟放出大量热 |
呼出气体中仍然含有 |
|
④ |
待白磷熄灭并冷却到室温,打开b |
C中液体到吸入B瓶中,C中剩余液体为400mL |
呼出气体中N2的体积分数为% |
该实验设计依据的N2性质有(填序号)
A 难溶于水 B 不能和NaOH溶液反应 C 无色无味的气体 D 不能燃烧,也不支持燃烧
(提出问题)为什么过氧化氢溶液涂到伤口上,分解就加快了呢?
(提出猜想)猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
|
序号 |
实验步骤 |
实验现象 |
实验结论 |
|
① |
用如图装置分两次进行实验,均注入5mL过氧化氢溶液。第一次在常温下进行,第二次将试管浸在37℃的温水中。 | 量筒中2分钟收集到的气体体积均为mL | 猜想1不正确 |
| ② | 用图甲装置分两次进行实验。第一次将装有过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液,第二次。 | 第一次,量筒中2分钟收集到的气体体积为56mL;第二次,量筒中2分钟收集到的气体体积为5mL。 |
①小林反思上述实验设计的缺陷(具体说明);
②要证明过氧化氢酶是该反应催化剂,还需证明其在反应前后和不变。
①取1.5毫克过氧化氢酶加入容器中,搅拌后塞紧橡皮塞。
②用注射器A从容器中抽出2毫升装置中空气,用注射器B将2毫升H2O2溶液注入容器中采集数据。直至反应结束。
③用3.1毫克、5.6毫克过氧化氢酶及3.1毫克、5.6毫克、10.7毫克相同颗粒大小的二氧化锰重复上述实验,获取数据如图丙。

①步骤②中“”操作目的是。
②小林分析相关数据,得出“相同条件下,过氧化氢酶对过氧化的催化能力比二氧化锰强”这一结论,其依据是。
③小林推测:过氧化氢酶质量过大,可能导致实验过程中过氧化氢分解突然变慢。请说明其理由。