
X、Y、Z、W代表所加溶液,X、Y、Z、W分别是( )


A.①③②④⑤⑥
B.③②①④⑤⑥
C.③①②⑤④⑥
D.②③①⑤④⑥
①氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳的条件下,使碳酸氢钠结晶析出,该反应的化学方程式是。
②写出步骤Ⅰ电解饱和NaCl溶液的化学方程式是。
③海水制镁。实际生产中,步骤Ⅲ常选用作为沉淀剂,从海水中提取MgCl2历经步骤Ⅱ、Ⅲ、Ⅳ三步转换的主要目的是。

操作③中的错误是。
计算:所需氯化钠质量为g,所需蒸馏水的体积为mL(水的密度约为1g/mL)。
称量:分别在天平左右两盘放上纸片,调节平衡后,应先放(填写“砝码”或“药品”)。
量取:准确量取所需蒸馏水。
溶解:该操作中玻璃棒的作用是。
实验反思:经检测,溶质质量分数偏小,其原因可能有(填序号)。
①氯化钠固体仍然不纯 ②烧杯洗涤后内壁不干燥
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
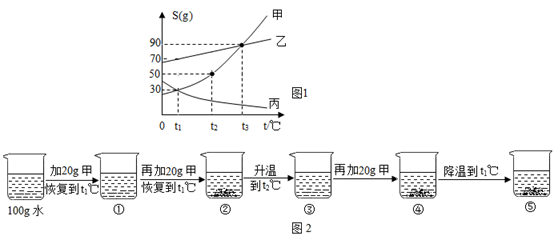
A 在溶液①~⑤中,属于饱和溶液的是②④⑤
B 与溶液②溶质质量分数相等的是⑤
C 杯④中所得溶液的质量为160g
D 烧杯⑤中固体的质量为30g
