 B . “郫”字青铜戈
B . “郫”字青铜戈  C . 龙纹铅饼币
C . 龙纹铅饼币  D . 黄金面具
D . 黄金面具 

| 选项 | A | B | C | D |
| 区分的物质 | 氢氧化钠和硝酸铵 | 饱和的硝酸钾溶液和饱和的澄清石灰水 | 铁粉和木炭粉 | 黄金和黄铜 |
| 方法一 | 观察颜色 | 升高温度 | 分别与稀盐酸混合 | 加热后观察颜色 |
| 方法二 | 加入水中观察 | 通入二氧化碳 | 观察颜色 | 加氯化镁溶液 |


|
实验操作 |
实验现象 |
实验结论 |
|
|
|
铁的金属活动性比铜强 |
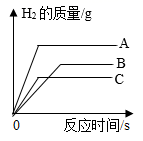
A若滤渣只含一种金属,则滤液中的溶质只有三种
B若滤液中含有两种金属离子,则滤渣中的固体只有两种
C若最终得到的滤渣质量仍为mg,则滤液中溶质最多有两种
D若向滤渣中加入稀盐酸,有气泡产生,则滤液中的溶质最多有两种

A 前面
B 后面
C 前后均可

检测废水呈酸性的方法是 .
①计算
m(KOH)= g,V(H2O) mL(水的密度近似为1.0g•mL﹣1).
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后 (按操作先后顺序,填字母),直至天平平衡.
A .向烧杯中加氢氧化钾固体 B .按需要添加砝码、移动游码
C .量取; D .溶解 E .转移.
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示.(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)

①P点对应溶液中一定存在的阳离子有 (填离子符号).
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%).
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.1%).

②铝能与氢氧化钠溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;镁和铁不能与氢氧化钠溶液反应。
[进行猜想]该易拉罐的金属组成除铝外,还可能含有镁、铁中的一种或两种。
[设计实验]小明取打磨后的铝易拉罐样品按如下方案进行实验。
|
实验步骤 |
实验现象 |
解释与结论 |
|
①取一定量的样品于烧杯中,加入足量的溶液,充分反应后,过滤、洗涤、干燥。 |
固体表面有大量气泡产生;过滤后得到大量黑色粉末。 |
样品中含有铝。 |
|
②取少量上述黑色粉末于试管中,加入足量的稀盐酸。 |
有大量气泡产生,溶液变成浅绿色。 |
样品中含有镁和铁。铁发生反应的化学方程式为 |
[实验结论]小明得出该易拉罐是由铝镁和铁组成。



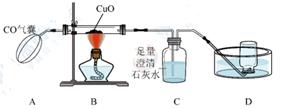
a 实验结束时应先熄灭B处酒精灯;
b C中增加的质量与B中固体减小的质量相等;
c 反应结束后继续通入一氧化碳的目的是防止铜被氧化。

(提出问题)发生复分解反应应具备哪些条件?
①硝酸钡溶液与稀硫酸
②稀硫酸与碳酸钾溶液
③稀盐酸与氢氧化钠溶液
④硝酸钡溶液与碳酸钾
①中有 ;
②中有 ;
③中有 ;
④中有两种离子,所以才发生化学反应。
