

 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 吸收NH3
D . 吸收NH3 
| 选项 | 实验操作及现象 | 结论 |
| A | 将充满氨气的试管倒置于滴有酚酞的水槽中,试管内迅速充满红色液体 | NH3极易溶于水且溶液显碱性 |
| B | 蔗糖中加入浓硫酸出现发黑现象 | 浓硫具有吸水性和强氧化性 |
| C | 向酸性KMnO2溶液中通入SO2 , 溶液褪色 | SO2有漂白性 |
| D | 向某盐溶液中加入NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中含有 |



已知:4Fe(CrO2)2+10Na2CO3 +7O2 8Na2CrO4+4NaFeO2+10CO2
2H++2 =
+H2O
下列说法正确的是( )
| 实验操作 | 实验现象 | 实验原理 |
| ①向盛有铍片的试管中加入足量6mol·L-1盐酸 | 开始无现象,一段时间后铍片逐渐溶解,并有大量气泡产生 | BeO+2HCl=BeCl2+H2O Be+2HCl=BeCl2+H2↑ |
| ②向盛有铍片的试管中加入足量3mol·L-1硫酸溶液 | 开始无现象,一段时间后,铍片表面缓慢放出少量气泡 | BeO+ H2SO4=BeSO4+H2O Be+H2SO4=BeSO4+H2↑ |
| ③向盛有铍片的试管中加入足量6mol·L-1氢氧化钠溶液 | 开始无现象,一段时间后铍片逐渐溶解,并有大量气泡产生 | BeO+2NaOH=Na2BeO2+H2O Be+2NaOH=Na2BeO2+H2↑ |
下列说法错误的是( )

回答下列问题:
A.稀盐酸
B.浓硫酸
C.稀硝酸
D.氯化铜溶液
有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为。

步骤②:向锥形瓶中加入浓HNO3 , 其操作方法是。
步骤③:证明三颈烧瓶中反应有NO生成,操作是,现象是。
步骤④:传感器数据显示c( NO3- )随反应时间逐渐增大,证明NO2与水反应生成 NO3- 。
经查阅资料知,不是SO2导致上述现象,验证该结论可使用的试剂是。

①配制1000mL5 ×10-3 mol·L-1的碘溶液,需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、 。
②将配制的溶液稀释10倍,量取5mL注人试管,加入2-3滴淀粉溶液,慢慢抽气,观察到溶液中(填实验现象)时,停止抽气,记录抽气次数n。该过程中发生反应的离子方程式为。
③空气中二氧化硫的最大允许含量为0.02mg·L-1。若每次抽空气100mL (标准状况),则n至少为次,才符合标准。抽气时应慢慢抽拉活塞,若抽拉过快,会造成测定结果(偏大、偏小、无影响)。
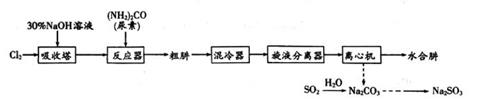
已知:①N2H4·H2O具有强还原性,易被氧化成N2。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成N2H4·H2O。
③尿素中氮元素为-3价。
回答下列问题:

已知:酸性越强,K2FeO4越容易发生反应生成O2。
回答下列问题:

①氢离子浓度为3×10-5mol·L-1时去除率低,原因是(用离子方程式表示)。
②最佳铁砷质量比为 ,理由是。