

| 体液 | 唾液 | 胃液 | 血液 | 尿液 |
| 正常pH范围 | 6.6~7.1 | 0.8~1.5 | 7.35~7.45 | 4.6~8.0 |
 B . 捣年糕
B . 捣年糕  C . 酿米酒
C . 酿米酒  D . 捏米塑
D . 捏米塑 
 B . 挂彩灯
B . 挂彩灯  C . 做糖人
C . 做糖人  D . 燃放烟花
D . 燃放烟花 
 B . 耕田
B . 耕田  C . 生火
C . 生火  D . 灌溉
D . 灌溉 

| 含氮 | 含磷 | 含钾 | |
| 土壤肥量标准(g/kg) | 0.62 | 0.34 | 17.8 |
| 测定结果(g/kg) | 0.40 | 0.38 | 13.6 |

a.氢氧化铝 b.苛性钠 c.熟石灰 d.醋酸
①可用来配制波尔多液的是。 ②可用来治疗胃酸过多的是。③可用来除去热水瓶中水垢的是。


|
酸 |
碱 |
相应的正盐 |
溶液的pH |
|
HCl(强酸) |
NaOH(强碱) |
NaCl |
7 |
|
H2SO4(强酸) |
KOH(强碱) |
K2SO4 |
7 |
|
H2CO3(弱酸) |
NaOH(强碱) |
Na2CO3 |
>7 |
|
H2PO4(弱酸) |
KOH(强碱) |
K3PO4 |
>7 |
|
HNO3(强酸) |
Cu(OH)2(弱碱) |
Cu(NO3)2 |
<7 |
|
HCl(强酸) |
Fe(OH)2(弱碱) |
FeCl3 |
<7 |
实验步骤 | 实验现象 | 实验结论 | |
甲 | 取少量灭火剂于试管中,加入一定量的 | 粉末逐渐溶解 | 该灭火剂不属于报道中的“假干粉” |
乙 | 取少量灭火剂于试管中,加入一定量的稀盐酸 |
乙同学设计方案中发生反应的化学方程式为 .
【查阅资料】1、碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;碳酸钠受热不分解.
2、碳酸氢钠溶解吸收热量;碳酸钠溶解放出热量.
【提出猜想】猜想1:残留主要成分是碳酸钠;猜想2:残留主要成分是 .
【设计方案】小组同学设计的下列实验方案中,错误的是 (填序号).
A、加热残留物质将产生的气体通入澄清的石灰水中,若观察到澄清石灰水变浑浊,则猜想2正确
B、将残留物溶于水,若有放热现象,则猜想1正确
C、将残留物溶于水,加过量氯化钙溶液静置,取上层清液加稀盐酸,若产生气泡,则猜想2正确
【反思评价】设计实验方案要思维缜密,考虑周全.用化学知识解释上述错误方案存在的主要问题 .
某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:

溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称是;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是.
(1)取少量该溶液于试管中,滴加酚酞试液,溶液变红色,则原溶液不可能是 溶液;
(2)另取少量该溶液于试管中,滴加BaCl2溶液,产生(填实验现象),则该溶液为Na2CO3溶液,其反应的化学方程式为 .
某白色固体由NH4Cl、Ba(NO3)2、K2SO4、Na2CO3中的三种组成,取样后加入足量的水,充分搅拌后,有白色沉淀生成,则原固体混合物的组成可能有 (填序号).
①NH4Cl、Ba(NO3)2、K2SO4
②HN4Cl、Ba(NO3)2、Na2CO3
③NH4Cl、K2SO4、Na2CO3
④Ba(NO3)2、K2SO4、Na2CO3 .
【猜想假设】
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
【查阅资料】Na2CO3溶液呈碱性
【设计方案】请你完善下表几组同学探讨的设计方案
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
| 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是: . |
第2组 |
| 若产生白色沉淀,反应方程式是: ,则猜想(1)不成立. | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立. |
第3组 |
| 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是: . |
【探究实验】综合各小组的方案后,动手实验.
【结论与反思】NaOH溶液易与空气中CO2反应而变质,所以要密封保存.
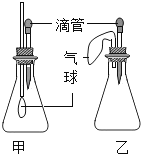
【拓展延伸】同学们设计了如图两套装置进行实验:
用胶头滴管吸取某种液体,锥形瓶中充入一种气体或放入一种固体物质,挤压胶头滴管.一段时间后,两装置中气球明显胀大.
(1)甲装置中可能发生反应的方程式是 .
(2)若乙装置中胶头滴管吸取的是稀盐酸,则锥形瓶中放入的固体可能是 .
某校化学兴趣小组的同学用如图装置进行木炭还原氧化铜的实验并进行相关探究实验.假定实验产生的二氧化碳全部被澄清石灰水吸收.将试管b中的混浊液过滤、洗涤、干燥、称量,理论上得固体物质2.00g.实验完毕后,发现试管a中仍有黑色固体物质.

【提出猜想】
李华同学:黑色固体物质是木炭
刘明同学:黑色固体物质是氧化铜
王军同学:黑色固体物质是木炭和氧化铜的混合物
【查阅资料】
木炭、铜都不溶于水也不能与稀硫酸发生反应;CuO、Fe2O3等能与稀硫酸反应生成盐和水.
【实验设计】
①将反应后试管a中的固体物质全部转入小烧杯c中,加入足量稀硫酸,用玻璃棒充分搅拌后,过滤,得到蓝色滤液e和固体物质f.
②将f全部转入坩埚中充分灼烧,看到燃烧现象.完全反应后,冷却、称量,理论上得固体物质4.80g.
②请对上述实验装置提出改进意见 .
实验一:向盛有一定量氢氧化钠固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管另一端通入盛有水的试管中,振荡左侧试管(如图).
实验二:用氧化钙代替氢氧化钠重复一次上述实验.
上述两个实验的相同现象之一是 ;
上述两个实验中,其中一个实验发生了化学变化,其化学方程式是 ;
另一个实验没有发生化学变化.
【本质归纳】
相同的实验现象,既可以由物理变化引起,也可以由化学变化引起.
【探究运用】
在探究白色粉末的组成时,要研究相同实验现象的本质区别.
实验三:有一包白色粉末可能含有硫酸钡、碳酸钾和氢氧化钡中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到烧杯中有白色不溶物.
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为,小明的结论不准确,其理由可用化学方程式表示为 .
针对上述两位同学的观点,小燕同学进一步设计如下实验方案进行探究:

(1)步骤②中发生化学反应的方程式是 .
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 (填化学式,下同);
步骤③中加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ,原白色粉末的可能组成是 ;
(3)小鹏同学认为,只需取少量滤渣B,加入过量的稀硝酸,若看到的现象是 ,就足以说明原白色粉末中只含有碳酸钾和氢氧化钡.
