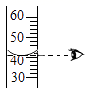
 B . 闻
B . 闻  C . 拿
C . 拿 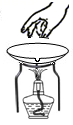 D . 滴
D . 滴 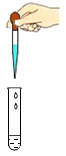
| 选项 | 宏观事实 | 微观解释 |
| A | 液态水受热变为水蒸气时体积增大 | 温度升高,分子体积变大 |
| B | 氧气经压缩可以储存在钢瓶中 | 压强增大,分子间的间隔变小 |
| C | 一氧化碳和二氧化碳化学性质不同 | 构成二者的分子不同 |
| D | 氢氧化钠溶液和氢氧化钙溶液具有相似的化学性质 | 两种溶液中都含有OH- |
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。

甲 乙 丙
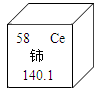
 ,硫原子的结构示意图为
,硫原子的结构示意图为  。
。 ①原子的核电荷数与核外电子总数的关系是。
②一个硫原子得到二个电子,形成一种新粒子,该粒子的符号为。



①图中碱性最强的体液是。
②该同学胃酸(主要成分为盐酸)过多,可服用胃舒平(主要成分为Al(OH)3)治疗,其原理是(用化学方程式表示)。
|
84消毒液 (产品特点)主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.1%~6.9% (餐具消毒)用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 (注意事项)①外用消毒剂,须稀释后使用。 ③不得将本产品与酸性产品(如洁厕类清洁产品)同时使用。 |
①NaClO中氯元素的化合价是。
②依据表中信息,将有效氯的质量分数为60%的84消毒液10g,配制有效氯的质量分数为0.04%的消毒浸泡液,需要水的质量为。
③洁厕灵(主要成分为盐酸〕与84消毒液混合会产生有毒的氯气(Cl2)。请将该反应的化学方程式补充完整: 2HCl+NaClO= +Cl2↑+H2O。


⑴步骤①中,用托盘天平称量5.0g粗盐。
⑵步骤②中,玻璃棒的作用是。
⑶步骤③中,滴加过量NaOH溶液除去MgCl2 , 如何判断滴加过量的NaOH溶液。
⑷步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是(填字母)。
A稀盐酸 B稀硫酸 C稀硝酸 D氯化钠溶液
⑸步骤⑥的操作名称是,当时,停止加热。

①仪器a的名称是。
②实验室制取CO2的化学方程式是;收集CO2可选用的装置是(填序号),检验CO2收集满的方法是。
④利用B装置制取CO2时,反应未停止前关闭止水夹,可观察到的现象是。
④与A装置相比,利用C装置制取CO2的优点是。

A甲中逸出的气体只含CO2
B乙中液体变红,证明CO2能与水反应
C加热后红色不褪去,说明碳酸受热不分解
D欲达到实验目的,可将盐酸改为稀硫酸

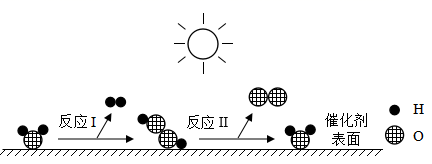
Ⅱ. CuO参与反应产生O2 , 反应前后质量和化学性质发生了改变;
Ⅲ. CuO是反应的催化剂,反应前后。

填写下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
|
带火星的木条复燃 |
| 溶液中有气泡放出 | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(拓展)要探究步骤⑤做过催化剂的CuO其它化学性质,还应补做的实验是(写一种)。
请用已学过的知识设计一个最简便的实验方案,来检验CuO经氢气还原所得到的红色产物中是否有Cu2O。
|
实验步骤 |
|
|
实验现象与结论 |
|
|
化学方程式 |
|
(查阅资料)稀硝酸(HNO3)具有酸的通性
(设计实验)流程如图:

(实验分析)
①若c处无现象,则该品牌干燥剂的成分为(写化学式)。
②若c处有白色沉淀生成,且沉淀质量为2.87g;白色沉淀a的质量为1.2g。则干燥剂的成分为(写化学式)。写出c处产生白色沉淀的化学方程式。
③该实验过程中,过量稀硝酸不能用过量的稀盐酸代替的原因是。